Die Durchführung der medikamentösen Antitumortherapie steht im Mittelpunkt dieses Themenbereichs. Neben den Applikationsarten und den dazugehörigen Hilfsmitteln werden die pharmazeutischen Aspekte der Parenteraliazubereitung behandelt. Dabei wird auch über deren Kompatibilität und Stabilität sowie Arbeitsschutzvorkehrungen berichtet. Abschließend geht es um das Verhalten bei Praravasten.
Durchführung der Chemotherapie
Jürgen Barth
1 Applikation von Zytostatika – Möglichkeiten und Hilfsmittel
Grundsätzlich kann eine grobe Einteilung der Zytostatikaapplikation in die systemische und die lokale bzw. regionale Applikation vorgenommen werden. Die gebräuchlichsten Applikationsarten sind zur Übersicht in folgender Tabelle wiedergegeben.
| Systemisch | Lokal/Regionala |
| Intravenös | Intraarteriell |
| peripher | Intrathekal/Intraventrikulär |
| zentral | Intraperikardial |
| Intramuskulär | Intrapleural |
| Subkutan | Intravesikal |
| Oral | Intraperitoneal |
| Topisch |
a Auch bei lokoregionaler Applikation kann es zu einer systemischen (Neben-)Wirkung kommen.
1.1 Systemische Applikation
1.1.1 Intravenös
Die intravenöse Applikation ist das Standardverfahren in der Therapie mit Zytostatika. Es kann dabei weiter unterschieden werden in periphervenöse und zentralvenöse Applikation. Die Wahl des jeweiligen Zugangs und des dazugehörigen Applikationssystems ist von einer Vielzahl von Faktoren abhängig. Dazu gehören:
- Art und Länge der Therapie
- Art der verwendeten Arzneimittel (Toxizität, Konzentration)
- stationäre oder ambulante Behandlung
- Patientenfaktoren (z. B. Venenverhältnisse des Patienten)
- Kompatibilität Arzneimittel – Applikationssystem
Periphere Systeme eignen sich nur für kurzfristige stationäre Aufenthalte und bergen – laut klinischer Erfahrung – ein höheres Risiko von Infektionen und Thrombophlebitiden (lokale Venenreizung). Diese Systeme müssen nach wenigen Tagen gewechselt werden. Es besteht eine viel größere Gefahr einer Dislozierung mit der Möglichkeit der Extravasation (siehe auch Abschnitt Verhalten bei Paravasaten).
Hilfsmittel zur periphervenösen Applikation
Die periphervenöse Applikation erfolgt fast ausschließlich über gut zugängliche Armvenen. Ein peripherer Zugang via Fußvenen ist vom Prinzip her möglich, aber in praxi eher die Ausnahme. Bei schlechten peripheren Venen wird meist eine Portanlage bevorzugt.
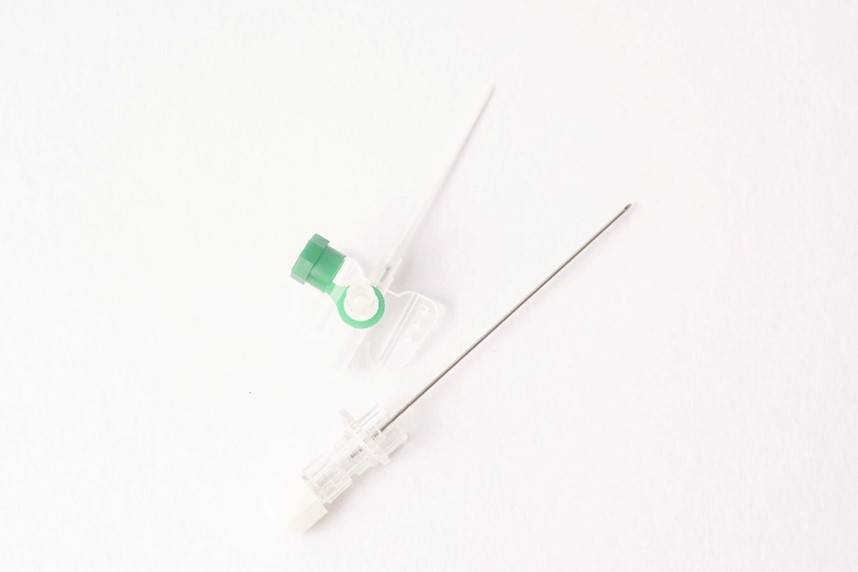
Hilfsmittel für eine periphervenöse Applikation sind im einfachsten Fall eine Spritze nebst i.v. Kanüle bzw. ein Infusionsbehältnis mit Infusionsbesteck und i.v. Kanüle (nicht mehr zeitgemäß). Üblich ist der Einsatz einer Venenkanüle als kurze bis mittelmäßig lange Verweilkanüle für eine Injektion oder Infusion (Abbildung links). Ein gesicherter venöser Zugang ist jedoch unabdingbar (siehe auch Abschnitt Verhalten bei Paravasaten).
Hilfsmittel zur zentralvenösen Applikation
Zentrale Venenkatheter: Geradezu protektive Bedeutung hat die zentralvenöse Gabe bei stark gefäß- oder gewebereizenden Substanzen. Hierbei ist eine Dislozierung des Systems unwahrscheinlicher als bei den Hilfsmitteln zur periphervenösen Applikation. Die Substanzen werden zudem im Blutkreislaufsystem sehr rasch verdünnt und abtransportiert, sodass es nicht zu lokalen Reizerscheinungen aufgrund von Substanz- oder Konzentrationseffekten kommt (pH-Wert, Osmolarität, hypertone Lösungen).
Für die zentralvenöse Gabe stehen aus Kunststoff bestehende, zentrale Venenkatheter (ZVK) zur Verfügung. Sie heißen auch Kavakatheter oder Vena-cava-Katheter bzw. (Sub-)Klavia-Katheter. Die entsprechenden Katheter sind meist in zwei- oder dreilumiger Ausführung (Abbildung folgende Seite) erhältlich, sodass nicht kompatible Substanzen, z. B. für Begleittherapien wie notwendige Spülungen, parallel laufen können. Dabei ist von entscheidender Bedeutung, ob jedes Katheterlumen eine eigene Austrittsöffnung hat oder ob jedes Lumen in einen gemeinsamen kurzen Schenkel mündet und der Katheter eine einzige Austrittsöffnung zum Gefäßsystem hat. Ist das der Fall, so kommt es zum Kontakt bzw. zur Vermischung der Substanzen im Katheterlumen. Sind diese untereinander inkompatibel, kommt es in der Folge zu den nicht erwünschten Effekten, wie beispielsweise:
- Inaktivierung einer oder mehrerer Komponenten (z. B. wird Oxaliplatin durch alkalische pH-Werte oder Elektrolyte inaktiviert; selbst eine Parallelinfusion von 5-FU mit einem pH-Wert ~ 8,5 verbietet sich)
- Reaktionen miteinander, unter Entstehung toxischer Produkte (z. B. Calcium parallel zu einer Fettemulsion; die Fettemulsion bricht, es kommt zu einer Fettembolie)
- Ausfällen/Aussalzen der Einzelkomponenten mit irreversiblem Verschluss des Katheters (z. B. Amsacrin wird durch Elektrolyte ausgesalzen, trübige Ausfällung von Heparin mit Cytarabin, sofortiges Ausfällen von Gentamicin mit Heparin)

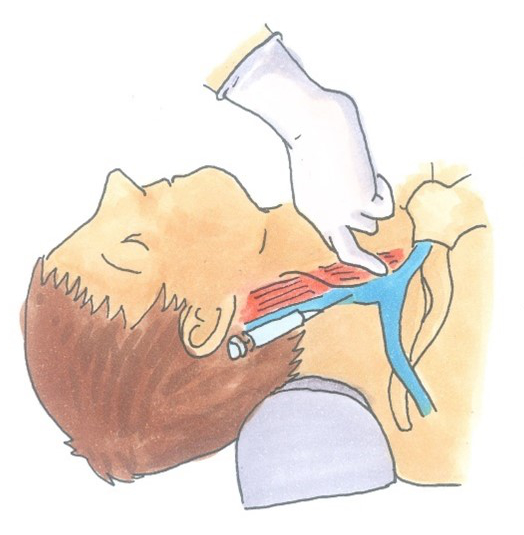
Bei der Anlage eines solchen Katheters handelt es sich um einen chirurgisch-operativen Eingriff (Abbildungen unterhalb). Der Zugang erfolgt meist über die Vena jugularis interna, seltener über die Vena subclavia, oder die Vena jugularis externa in das venöse Gefäßsystem. Dann wird der Katheter via Vena cava superior herznah (rechter Vorhof) vorgeschoben. Vom Grundsatz her ist auch ein Zugang über die untere Körperhälfte (Vena saphena, Vena femoralis) mit Lage in der Vena cava inferior möglich.

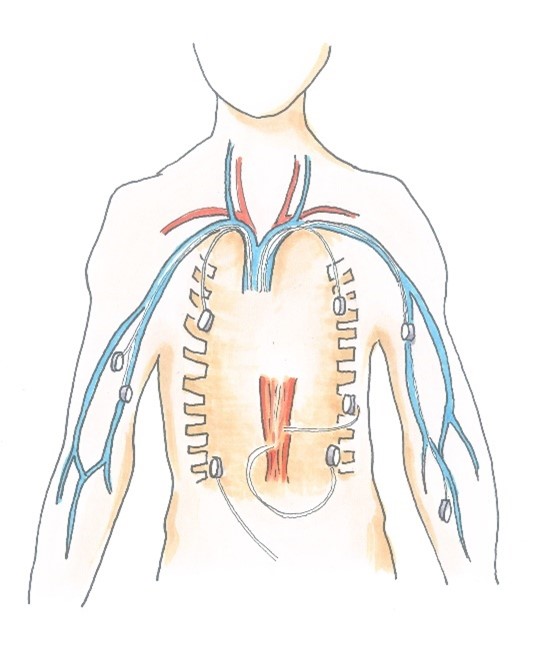
Ports und Pumpensysteme für Ports: Bei Portsystemen wird ein Kathetersystem mit Reservoir in eine subkutane Tasche implantiert. Über einen – üblicherweise einlumigen – Katheter wird ein Zugang zu einer großen Vene geschaffen. Ports und Portsysteme sind quasi eine besondere Art eines ZVK. Man wird sich für einen solchen Zugang bei langfristigem oder häufig benötigtem Gefäßzugang entscheiden. Ein solcher Port benötigt meistens spezielle Nadeln (z. B. Huber-Nadel). Voraussetzung bzw. sinnvoller Einsatz solcher Ports sind mobile (d. h. ambulante oder tagesstationäre) Patienten.
Empfehlungen zur Portpflege
- Eine Punktion des Ports ist streng aseptisch vorzunehmen.
- Eine gewissenhafte Behandlung des Portkatheter-Systems erhöht dessen Haltbarkeit und Verweildauer. Zudem sind die bekannten Methoden zur Applikation der Infusionslösung und zur Pflege des Katheters zu beachten.
- Zur Portpunktion sind ausschließlich Portnadeln mit Spezialschliff, die nicht materialabtragend sind, zu benutzen. Herkömmliche Nadeln würden Stückchen aus der Silikonmembran über der Portkammer herausdrücken und die Membran verletzen. In der Folge kann sie undicht werden oder es kommt zu Verschlüssen des Portkatheters.
- Zu beachten ist, dass die Portnadel nicht über die Haut hinausreicht. Zu lange Nadeln werden unter Umständen beim Einführen beschädigt; zieht man sie heraus, kommt es entsprechend zu Verletzungen der Silikonmembran. Die Membran kann durchlässig werden oder die Silikonpartikel verschließen den Portkatheter.
- Die Nadeln dürfen auch nicht zu kurz sein, da sie die Silikonmembran dann möglicherweise nicht ganz durchstechen. In diesem Fall läuft die Infusion nicht in die Portkammer ein, sondern möglicherweise in das umliegende Gewebe, und/oder es kommt zu einer Blockierung der Nadel.
- Wenn der Port gespült wird, dürfen nur Spritzen mit einem Volumen von mindestens 10 ml benutzt werden. Kommen Spritzen mit einem kleineren Volumen zum Einsatz, kann sich ein größerer Druck aufbauen und den Portkatheter zerstören.
- Die behandelnde Ärztin ordnet an, wie oft die Portnadel ausgetauscht wird. Bei einigen Patienten wird die Portnadel entfernt, wenn die Infusionstherapie zu Ende ist. Für die nächste Infusion erfolgt dann eine erneute Punktierung des Ports.
- Üblicherweise – falls nichts anders ärztlich angeordnet – wird die Portnadel nach dem Ende der Infusion belassen. Dann ist es nach den Leitlinien der Deutschen Gesellschaft für Ernährungsmedizin e. V. aber notwendig, sie jeden 3. bis 7. Tag auszutauschen.
- Um eine liegende Portnadel abzudecken, ist ein Verband aus steriler Gaze oder steriler durchsichtiger semipermeabler Folie aufzubringen.
- Der behandelnde Arzt ordnet abhängig vom Zustand der Punktionsstelle an, wie oft der Verband zu wechseln ist.
CAVE! Um dislozierte oder falsch positionierte Portnadeln rechtzeitig zu erkennen, ist der Umgang damit zu trainieren!

Für über bestimmte Zeiträume gesteuerte Infusionen kann ein solcher Port auch mit einem Pumpensystem beschickt werden. Pumpensysteme für Ports eignen sich grundsätzlich zur:
- Chemotherapie
- Antibiotikatherapie (Mukoviszidose, HIV)
- Analgetikatherapie bei Patienten mit chronischen Erkrankungen
Für das letztgenannte Anwendungsgebiet kommen derzeit der höheren Präzision wegen überwiegend elektronische Pumpen zum Einsatz, obwohl es auch für diese Indikation Einmalpumpen gibt.
Die Pumpen lassen sich vom Grundsatz her in folgende Typen einteilen:
- Elastomerpumpen
- mechanische Pumpen
- Peristaltikpumpen
Elastomerpumpen (z. B. Intermate®, Infusor®, Surefuser®, Easypump®) funktionieren nach dem Prinzip eines sich entleerenden „Ballons“. Ein ballonartiges Infusionsreservoir wird mit der Infusionslösung befüllt. Der Infusionsdruck wird durch die Elastizität des Ballons aufgebaut. Ein spezieller Durchflussbegrenzer, die sogenannte Steuerkapillare, sorgt für eine konstante und damit berechenbare Infusionsgeschwindigkeit. Einflussfaktoren hierauf sind z. B. die (Umgebungs-)Temperatur oder die Viskosität der Arzneimittellösung. Anders ausgedrückt: Fast alle Systeme sind hinsichtlich ihrer Laufpräzision auf ein bestimmtes Lösungsmittel bei bestimmter Temperatur geeicht. Zur „Temperaturregelung“ werden die Systeme entweder direkt auf der Haut oder in unmittelbarer Körpernähe getragen (auf Körpertemperatur kalibriert). Bedingt durch die unterschiedlichen Arzneimittelzusätze und gegebenenfalls andere Lösungsmittel können sich in der Praxis mehr oder weniger große Abweichungen von diesen Basiswerten ergeben. Bei Abweichungen (eigene Beobachtungen, Patientenangaben) sollten diese „Erfahrungswerte“ gesammelt werden. Elastomerpumpen sind Einmalsysteme, die nach Gebrauch zu verwerfen sind.
Mechanische Pumpen (z. B. Ultraflow®, Ultrasafe®, Onkoworker®) erhalten ihren Infusionsdruck durch eine Metallfeder, die den Infusionsbeutel komprimiert. Auch hier wird mithilfe eines Durchflussbegrenzers für eine konstante Infusionsgeschwindigkeit gesorgt. Wie bei den Elastomerpumpen besteht auch bei diesem System die Abhängigkeit der Infusionsgeschwindigkeit von Temperatur und Viskosität. Die Pumpe als solches kann mehrfach verwendet werde. Der Infusionsbeutel ist Einmalmaterial.
Peristaltikpumpen (z. B. Logomed-Pumpe®, CADD®, Pegasus PCA®, Curlin 6000) sind kleine Schlauch- oder Peristaltikpumpen, die elektrisch (Batterie) betrieben werden. In der Regel können sie auf verschiedene Infusionsgeschwindigkeiten eingestellt/programmiert werden. Pumpen für die Schmerztherapie sind teilweise auch variabel programmierbar und ermöglichen automatische oder patientenkontrollierte Bolusgaben (PCA = Patient Controlled Analgesia; Patientenkontrollierte Analgesie). Aufgrund des Funktionsprinzips ist die Temperatur- und Viskositätsabhängigkeit dieser Systeme wesentlich geringer als bei den Elastomerpumpen. Allerdings besteht die Abhängigkeit von der Stromversorgung. Moderne Systeme verfügen unter anderem über automatische Alarmeinrichtungen, sind aber sehr teuer. Das Infusionsreservoir stellt den nach Gebrauch zu verwerfenden Einmalartikel dar. Die Pumpensysteme an sich sind bei regelmäßiger Wartung (TÜV, gemäß Medizinproduktegesetz) beliebig oft wiederverwendbar.
Eine Sonderform der niedrigvolumigen gesteuerten (Dauer-)Infusion ist die Applikation mit einer Perfusorspritze (Abbildung unterhalb). Die Patienten sind damit vom Grundsatz her mobil, allerdings ist dieses System mobilen stationären Patienten vorbehalten (preiswertes Verbrauchsmaterial: Perfusorspritze; relativ hohe Anschaffungskosten: Perfusor); vergleiche auch: lokoregionale Applikation.
Wichtig für alle Pumpensysteme für Ports: Aufgrund der unterschiedlichen Kunststoffmaterialien in den Systemen muss prinzipiell die Kompatibilität mit dem jeweiligen Arzneimittel bestimmt werden. Daher sollten grundsätzlich nur solche Kombinationen eingesetzt werden, für die positive Untersuchungsdaten vorliegen. Vorteile solcher Systeme liegen auf der Hand:
- Mobilität für den Patienten
- einfache Bedienbarkeit
- teilweise Programmierbarkeit
- Unauffälligkeit
- (Applikations-)Sicherheit
- Therapiekosten (?)
Die Systeme zeigen aber (produktabhängig) auch Nachteile:
- limitiertes/ungünstiges Volumen
- unterschiedliche Materialien
- z. T. starke Abhängigkeit von Temperatur und Eigenschaften der Lösung (Viskosität!)
- z. T. zeitintensive Befüllung
- relativ hoher Preis für einen Einmalartikel
- gegebenenfalls hoher Batterieverbrauch
Der Vollständigkeit halber sei erwähnt, dass es mittlerweile auch vollständig implantierbare Pumpensysteme gibt (z. B. Pfizer Infusaid®, Medtronic SynchroMed®). Diese Systeme sind äußerlich nicht sichtbar und sollen sich hoher Compliance erfreuen. Sie sind allerdings teuer und es bedarf eines chirurgischen Eingriffs (Implantation). Die Befüllung erfolgt wie bei Ports mit einer stanzfreien Huber-Nadel. Das Applikationsvolumen ist begrenzt (18–50 ml). Die Steuerung der Pumpen erfolgt entweder elektrisch (Batterie) oder mechanisch mittels eines aufgebauten Gasdrucks in einer sogenannten Zwei-Kammer-Pumpe. Etablierte Schemata für solche Systeme existieren derzeit für Zytostatika nicht.
1.1.2 Intramuskulär/Subkutan
Voraussetzung für diese Art der Arzneimittelgabe ist eine ausreichende Resorbierbarkeit der Substanzen bei hinreichender Gewebeverträglichkeit. Die Applikation ist relativ einfach, da kein Gefäßzugang geschaffen werden muss. Aus Verträglichkeitsgründen sollte, wenn substanzbedingt möglich, das Injektionsvolumen nicht zu groß gewählt werden. Substanzen, die stark gewebereizende Eigenschaften besitzen (z. B. Anthrazykline, Vinca-Alkaloide; allgemeine Nekrotika siehe Abschnitt Verhalten bei Paravasaten) sind für diese Applikationsart kontraindiziert. Ebenso verbietet sich der Einsatz bei thrombozytopenischen Patienten wegen der erhöhten Blutungsgefahr (Hämatombildung). Zur i.m. Gabe sind derzeit nur noch Bleomycin, Cytarabin und Methotrexat zugelassen. Onkologika für die s.c. Gabe sind in der nachfolgenden Tabelle gelistet.
| Zytostatika | Zytokine | Antikörper |
| Azacitidin# | Aldesleukin (IL-2) | Alemtuzumab* |
| Bortezomib | Erythropoetin | Atezolizumab |
| Cladribin | Filgrastim | Daratumumab s.c. |
| Cytarabin | Interferone | Rituximab s.c. |
| Erwinase | Lenograstim | Talquetamab |
| MTX | Lipegrastim | Teclistamab |
| PEG-Filgrastim | Trastuzumab s.c. | |
| # Auch die zugelassene s.c. Applikation führt vielfach zu Hautreizungen. * Keine onkologische Zulassung mehr. S.c. Gabe war nie explizit zugelassen, wurde aber aus Gründen der besseren Verträglichkeit basierend auf einer Studie von Lundin et al. (2002) so praktiziert (Blood 100: 768–773). | ||
Hilfsmittel zur intramuskulären/subkutanen Gabe: Spritze, Kanüle/Subkutankanüle
1.2 Orale Gabe
Orale Zytostatika gibt es schon sehr lange. 6-Mercaptopurin oder Thioguanin sind seit den 1960er-Jahren im Gebrauch. Mit den neuen niedermolekularen Kinase-Inhibitoren (nmKI) wurde die Palette der „Zytoralia“ erheblich erweitert und sie wächst ständig (Tabelle unten).
Viele Patienten geben einer oralen Therapie den Vorzug, wenn sie die Wahl haben. Sie können ihr Leben so flexibler gestalten und haben mehr Lebenszeit zur Verfügung als Patienten, die für Infusionstherapien zu definierten Zeiten, gegebenenfalls mehrmals wöchentlich, einen Arzt aufsuchen müssen. Orale Therapien sind jedoch nur dann von Vorteil, wenn die Compliance der Patienten und die individuelle Verträglichkeit gewährleistet sind.
Non-Compliance oder Falschanwendung wegen ungenügender Patientenunterweisung können nicht nur den Therapieerfolg bedrohen, sondern im schlimmsten Fall auch das Leben des Patienten gefährden. So ist neben Unverträglichkeiten auch an Interaktionen zu denken; Letzteres nicht nur in Bezug auf andere Medikamente, sondern auch auf den Einnahmezeitpunkt (nüchtern / nicht nüchtern) (siehe Teil Grundlagen, Abschnitt Wechselwirkungen).
| Substanzklasse | Wirkstoffe (INN) |
| Alkylanzien | Busulfan, Chlorambucil, Cyclophosphamid, Estramustin, Lomustin, Melphalan, Procarbazin, Temozolomid, Treosulfan, Trofosfamid |
| Antimetabolite | Capecitabin, Fludarabinphosphat, Methotrexat, Mercaptopurin, Tegafur + Gimeracil + Oteracil (vormals S 1), Tegafur + Uracil, Tioguanin, Trifluridin/Tipiracil |
| Podophyllotoxinderivate | Etoposid |
| Topoisomerase-I-Hemmer | Topotecan |
| Topoisomerase-II-Hemmer | Idarubicin |
| Vinca-Alkaloide | Vinorelbin |
| Sonstige | Hydroxycarbamid, Mitotan, Hormone/Antihormone (diverse) |
| IMiDs® | Lenalidomid, Pomalidomid, Thalidomid |
| nmKI (nur Tyrosin- und Serin/ Threoninkinase-Inhibitoren) | Abemaciclib, Acalabrutinib, Afatinib, Alectinib, Alpelisib, Asciminib, Avapritinib, Axitinib, Binimetinib, Bosutinib, Brigatinib, Cabozantinib, Capivasertib, Capmatinib, Ceritinib, Cobimetinib, Crizotinib, Dabrafenib, Dacomitinib, Dasatinib, Duvelisib, Encorafenib, Entrectinib, Erdafitinib Erlotinib, Everolimus, Fedratinib, Fruquintinib, Futibatinib, Gefitinib, Gilteritinib, Ibrutinib, Idelalisib, Imatinib, Lapatinib, Larotrectinib, Lenvatinib, Lorlatinib, Midostaurin, Momelotinib, Neratinib Nilotinib, Nintedanib, Osimertinib, Palbociclib, Pazopanib, Pemigatinib, Pexidartinib, Ponatinib, Pralsetinib, Quizartinib, Regorafenib, Reprotrectinib, Ribociclib, Ripretinib, Ruxolitinib, Selpercatinib, Selumetinib, Sorafenib, Sunitinib, Tepotinib, Tivozanib, Trametinib, Tucartinib, Vandetanib, Vemurafenib, Zanubrutinib |
| Sonstige Enzymhemmstoffe | |
| GTPase- Inhibitoren | Adagrasib, Sotorasib |
| HDAC-Inhibitoren | Panobinostat |
| Hedgehog-Inhibitoren (SMO) | Glasdegib, Sonidegib, Vismodegib |
| IDH 1/2 Hemmstoffe | Enasidenib, Ivosidenib |
| Hemmstoffe der Ornithindecarboxylase | Eflornithin |
| PARP-Inhibitoren | Niraparib, Olaparib, Rucaparib, Talazoparib |
| Proteasom-Inhibitoren | Ixazomib |
| Hemmstoffe der γ-Sekretase | Niregacestat |
| Hemmstoffe von Regulatorproteinen | |
| BCL-2 | Venetoclax |
| Hemmstoffe von Transportproteinen | |
| XPO 1 | Selinexor |
| Es sind auch Wirkstoffe gelistet, die zum Zeitpunkt der Manuskripterstellung nicht in Deutschland zugelassen sind (EU-Ausland, USA) HDAC = Histondeacetylase IDH = Isocitratdehydrogenase IMiDs® = Immunmodulatory imide Drugs nmKI = niedermolekulare Kinase-Inhibitoren; Tyrosin- und Serin-/Threoninkinase-Inhibitoren PARP = Poly-(ADP-Ribose-)Polymerase | |
Merke: Bei oralen Tumortherapeutika ist eine angemessene Beratung und Schulung der Patienten durch den Arzt, den Apotheker und die Pflege entscheidend. Patienten müssen zu Therapiebeginn zwingend mit den Einnahmehinweisen und den möglichen Nebenwirkungen vertraut sein.
1.2.1 Einnahmezeitpunkte
Der korrekte Einnahmezeitpunkt war ein jahrzehntelang unterschätztes Problem. Der Magen selbst ist kein Resorptionsorgan. In ihm werden die Wirkstoffe aus der oralen Darreichungsform (Kapsel, Tablette) freigesetzt.
Dort können sie sich im sauren Magensaft zersetzen, was aber bei der Arzneistoffentwicklung berücksichtigt wird. Allerdings kann es in Abhängigkeit des Füllungszustandes des Magens zu nachteiligen Reaktionen kommen. Einige Wirkstoffe müssen nüchtern eingenommen werden, da sie sich im Speisebrei, insbesondere bei langer Verweildauer, zersetzen. Oder sie reagieren mit Nahrungsbestandteilen. Calcium- und magnesiumreiche Mineralwässer oder Mineralstoffpräparate (Eisen, Zink) können schwer und/oder langsam lösliche Komplexe mit Wirkstoffen bilden, so z. B. die Bisphosphonate zur Behandlung der Osteoporose oder der tumorbedingten Hyperkalzämie. Auch die antibiotisch wirkenden Gyrasehemmer wie Ciprofloxacin bilden schwer lösliche Calcium- und Magnesiumkomplexe. Ebenso das ITP-Medikament Eltrombopag und die Virustatika Elvitegravir und Ledipasvir.
Merke: Das beste Einnahmemedium für orale Tumortherapeutika ist ein calcium- und magnesiumarmes Wasser (geringer Anteil mehrwertiger Ionen).
1.2.2 Food-Effekte – Einfluss der Nahrung
Es gibt eine ganze Reihe von Wirkstoffen, die unabhängig, also mit oder ohne Nahrung, eingenommen werden können. Man muss sich also keine Gedanken zum Einnahmezeitpunkt machen.
1.2.2.1 Positiver Food-Effekt
Erhöht die gleichzeitige Nahrungsaufnahme die Bioverfügbarkeit (BV) von Wirkstoffen, so spricht man von einem positiven Food-Effekt. Das ist zunächst einmal nichts Schlimmes, denn es gibt auch Wirkstoffe, die diesen Effekt unbedingt brauchen. So hat Nintedanib eine Nüchtern-Bioverfügbarkeit von < 5 %, was für ausreichende Wirkspiegel zu gering ist. Nintedanib muss zwingend mit einer Mahlzeit eingenommen werden, damit eine ausreichende Bioverfügbarkeit von ca. 20 % erreicht wird. Das Essen schleppt sozusagen den Wirkstoff mit in das System. Auffälligerweise müssen viele Virustatika für eine ausreichende Bioverfügbarkeit mit der Nahrung eingenommen werden, z. B. Cobicistat (im Fixkombinationspräparat Stribilid®), Dasabuvir, Elvitegravir (im Fixkombinationspräparat Stribilid®), Rilpivirin (im Fixkombinationspräparat Eviplera®), Ritonavir, Tenofovir, Simeprevir, Sofosbuvir. Ein positiver Food-Effekt kann die Bioverfügbarkeit von Wirkstoffen aber derart erhöhen, dass toxische Konzentrationen im Blut erreicht werden. Diese Substanzen müssen daher nüchtern eingenommen werden. Zu nennen wären: Erlotinib, Lapatinib, Nilotinib, Pazopanib und Olaparib Hartkapseln. Bei Letzterem liegt es an der Galenik und nicht am Wirkstoff. Die Filmtabletten können zu jeder Zeit eingenommen werden. Die Wirkstoffe mit potenziell toxischem positiven Food-Effekt sind in der Übersichtstabelle unterhalb mit (BV+) gekennzeichnet, was bedeutet, dass, wenn sie nicht nüchtern eingenommen werden, die Bioverfügbarkeit in toxische Bereiche steigt.
1.2.2.2 Negativer Food-Effekt
Beim negativen Food-Effekt bewirkt eine zeitnahe Nahrungsaufnahme eine Verminderung der Bioverfügbarkeit in subtherapeutische Dosen. Ein Einnahmeabstand von 30 Minuten vor einer Mahlzeit ist auf jeden Fall zu gering für ein Medikament, das, aus welchen Gründen auch immer, nüchtern eingenommen werden muss. Der Abstand vor oder nach einer Mahlzeit sollte im Stundenbereich liegen.
Merke: Muss ein Medikament nüchtern eingenommen werden, so sind 30 Minuten vor einer Mahlzeit ein zu geringer Zeitabstand.
Es folgen zwei Übersichtstabellen zu den Einnahmezeitpunkten der Nicht-Kinase-Inhibitoren so wie der nmKI und weiterer Enzym- und Protein-Inhibitoren. Bei einigen Altsubstanzen ist der korrekte Einnahmezeitpunkt nicht bestimmt worden bzw. nicht genau bekannt.
| Einnahme mit der Nahrung | Einnahme ohne Nahrung | Egal |
| Capecitabin1 | Chlorambucil | Anagrelid |
| Mitotane2 | Decitabin/Cedazurin | Azacitidin |
| Tretionin | Estramustinphosphat | Bexaroten |
| Trifluridin : Tipiracil (1 : 0,5)3 | Etoposid4 | Busulfan |
| Vinorelbin | Lomustin8 | Cyclophosphamid5 |
| Melphalan9 | Fludarabin | |
| Methotrexat | Hydroxycarbamid | |
| Tegafur : Uracil (1 : 4) | Idarubicin | |
| Temozolomid4 | Lenalidomid | |
| Tioguanin4 | Mercaptopurin6 | |
| Pomalidomid | ||
| Procarbazin | ||
| Tegafur : Gimeracil : Oteracil (S 1) | ||
| Thalidomid | ||
| Topotecan | ||
| Treosulfan7 | ||
| Trofosfamid5 | ||
| 1 mit der Mahlzeit besser verträglich, deshalb innerhalb 30 Minuten nach einer Mahlzeit 2 am besten mit fettreicher Mahlzeit 3 innerhalb 1 Stunde nach einer Mahlzeit 4 auf nüchternen Magen 5 dazu ausreichend trinken, keine genauen Angaben zur Mahlzeit in Fachinformation 6 immer entweder mit oder ohne Mahlzeit, mindestens 1 Stunde vor oder 2 Stunden nach Milchprodukten 7 mit Milch oder Nahrung besser verträglich 8 mindestens 3 Stunden nach einer Mahlzeit oder abends vor dem Schlafengehen 9 mindestens 30 Minuten vor einer Mahlzeit, besser > 1 h; veraltete/nicht aktualisierte Fachinformation | ||
| Einnahme mit der Nahrung | Einnahme ohne Nahrung | Egal |
| Alectinib | Afatinib | Abemaciclib |
| Alpelisib1 | Asciminib | Acalabrutinib |
| Bosutinib | Avapritinib (BV+) | Axitinib |
| Ceritinib5 | Cabozantinib (BV+) | Binimetinib |
| Imatinib | Dabrafenib | Brigatinib |
| Midostaurin | Erlotinib (BV+) | Capivasertib |
| Neratinib | Lapatinib (BV+) | Capmatinib |
| Nintedanib | Nilotinib (BV+) | Cobimetinib |
| Regorafenib2 | Pazopanib (BV+) | Crizotinib |
| Tepotinib | Pexidartinb (BV+) | Dacomitinib |
| Pralsetinib (BV+) | Dasatinib | |
| Trametinib | Duvelisib | |
| Encorafenib | ||
| Entrectinib | ||
| Erdafitinib | ||
| Everolimus3 | ||
| Fedratinib | ||
| Fruquintinib | ||
| Futibatinib | ||
| Gefitinib | ||
| Gilteritinib | ||
| Ibrutinib4 | ||
| Idelalisib | ||
| Larotrectinib | ||
| Lenvatinib | ||
| Lorlatinib | ||
| Momelotinib | ||
| Osimertinib | ||
| Palbociclib | ||
| Pemigatinib | ||
| Pirtobrutinib | ||
| Ponatinib | ||
| Quizartinib | ||
| Reprotrectinib | ||
| Ribociclib | ||
| Ripretinib | ||
| Ruxolitinib | ||
| Selpercatinib | ||
| Selumetinib | ||
| Sorafenib6 | ||
| Sunitinib | ||
| Tivozanib | ||
| Tucatinib | ||
| Vandetanib | ||
| Vemurafenib | ||
| Zanbrutinib | ||
| Sonstige (Enzym-)Inhibitoren | ||
| Venetoclax | Ixazomib | Adagrasib |
| Olutasidenib | Eflornithin | |
| Sonidegib (BV+) | Enasidenib | |
| Glasdegib | ||
| Ivosidenib | ||
| Nirogacestat | ||
| Niraparib | ||
| Olaparib | ||
| Panobinostat | ||
| Rucaparib | ||
| Selinexor | ||
| Sotorasib | ||
| Talazoparib | ||
| Tazemetostat | ||
| Vismodegib | ||
| 1 unmittelbar nach Mahlzeit 2 nach leichter Mahlzeit 3 immer entweder mit oder immer ohne Mahlzeit 4 keine genauen Angaben zur Mahlzeit in FI (BV+) 5 Die Mahlzeit kann von einer leicht bis hin zu einer vollwertigen Mahlzeit variieren. 6 unabhängig von Mahlzeit oder zusammen mit einer leicht oder mäßig fettreichen Mahlzeit, bei fettreicher Mahlzeit mindestens 1 Stunde vor oder 2 Stunden nach der Mahlzeit (BV+) = muss nüchtern eingenommen werden, sonst steigt die Bioverfügbarkeit in toxische Bereiche | ||
Hormonpräparate
| Einnahme mit der Nahrung | Einnahme ohne Nahrung | Egal |
| Darolutamid | Abirateron (BV+) | Anastrozol |
| Elacestrant | Apalutamid | |
| Bicalutamid | ||
| Enzalutamid | ||
| Exemestan | ||
| Letrozol | ||
| Relugolix | ||
| (BV+): muss nüchtern eingenommen werden, da mit der Nahrung die Bioverfügbarkeit steigt | ||
Eine Aktualisierung zu den Einnahmezeitpunkten ist unter den Beratungstools auf der Internetseite der Deutschen Gesellschaft für Onkologische Pharmazie (DGOP) zu finden (https://www.orale-krebstherapie.de/fuer-fachkreise/beratungstools/). Dort findet sich auch eine Übersicht zu problembehafteten Kombinationen von oralen Zytostatika und ausgewähltem Obst, in erster Linie mit Grapefruit und verwandten, Furanocoumarine enthaltende Früchte (siehe auch Lit. 2).
1.2.3 Weitere Nahrungs- und Bioverfügbarkeitsphänomene
Auch bei diversen „klassischen“ Zytostatika (Nicht-Kinase- und Enzym-Inhibitoren) finden sich Bioverfügbarkeitsprobleme bei der Einnahme mit oder ohne Nahrung. Während Chlorambucil eine Bioverfügbarkeit (BV) von 70–80 % aufweist, kommt es zu einer verzögerten Resorption durch gleichzeitige Nahrungsaufnahme um 10–20 %. Die resultierende AUC sinkt ebenfalls um 10–20 %. Daher sollte Chlorambucil nüchtern eingenommen werden. Die Fachinformation Leukeran® empfahl bis min. 2012 die Einnahme mindestens eine halbe Stunde vor der Mahlzeit. Diese „merkwürdige“ halbe Stunde, die sich bei diversen anderen Arzneimitteln (Melphalan Filmtabletten, ältere Nicht-Zytostatika), die ebenfalls nüchtern eingenommen werden müssen, findet, ist aber niemals systematisch untersucht worden. Gemäß des deutschen Arzneibuchs müssen nicht-modifizierte Oralia (Nicht-Retardtabletten oder -kapseln) binnen 30 Minuten im sauren Magensaft zerfallen. Der Magen ist aber, wie erwähnt, kein Resorptionsorgan. Erst nach der Passage in den Dünndarm findet die Resorption statt. Aus heutiger Sicht ist eine Magen-Darm-Transitzeit (MDT) von ca. 30 Minuten selbst für schnell zerfallende Tabletten dramatisch unterschätzt. So wird bei gesunden (!) Menschen für reine Getränke auf Wasserbasis eine MDT von 0 bis 1 Stunde angegeben. Die Fachinformation von Leukeran® wurde den Erkenntnissen angepasst. Seit 2016 ist zu lesen: Durch eine Einnahme der Leukeran 2 mg Filmtabletten unmittelbar nach einer Mahlzeit wird die Resorption des Wirkstoffs verzögert und insgesamt auch verringert. Daher wird empfohlen, die Tabletten mindestens eine Stunde vor dem Essen bzw. drei Stunden nach dem Essen einzunehmen. Ähnlich dem Chlorambucil verhält es sich mit Melphalan. Die Nüchtern-BV beträgt ca. 85 % und sinkt bei zeitnaher Nahrungsaufnahme auf 58 %. Hinzu kommt, dass die Resorption von Melphalan durch Aminosäuren, insbesondere L-Leucin, vermindert wird. Leucinreiche Lebensmittel sind beispielsweise Weizenkeime, Thunfisch, Erdnüsse, Lachs, Rindfleisch, Filet, Kichererbsen, Hüttenkäse und unpolierter Reis. Patienten sollten leucinreiche Lebensmittel daher während der oralen Melphalantherapie meiden und die Substanz aus Gründen der drastisch sinkenden BV nüchtern einnehmen.
Wird Procarbazin gleichzeitig mit tyraminreicher Nahrung (Käse, eingelegter Hering, Hefeextrakte) eingenommen, kommt es bei Patienten zu klinisch relevanten hypertensiven Krisen, schlimmstenfalls auch zu einem Serotoninsyndrom.
Problematisch ist auch Etoposid, denn neben inter- und intraindividuellen Schwankungen hängt die Bioverfügbarkeit hier von der eingenommenen Dosis ab. Wird die Dosis schrittweise von 100 mg auf 600 mg per Einzelgabe erhöht, so erfolgt keine analoge Erhöhung der AUC, sondern diese sinkt disproportional. In der Konsequenz muss die Antwort auf die Patientenfrage: „Ich habe heute Morgen vergessen, meine Etoposidtabletten einzunehmen. Soll ich heute Abend die doppelte Menge einnehmen?“ entschieden „Nein“ heißen.
Orales Treosulfan darf im Fall von Schluckbeschwerden keinesfalls auf ein mit Wasser gefülltes Glas aufgestreut werden. Es kommt unverzüglich zur Abspaltung kleiner Mengen Methansulfonsäure, die der gesamten Flüssigkeit sofort einen pH-Wert von 1 verleiht.
Neben Enzymhemmstoffen und Induktoren des Zytochrom-P-450-Isoenzyms 3A4 (CYP P-450 3A4) kann auch der Genuss von Tabak für eine Enzyminduktion sorgen. So bewirkt gleichzeitiges Rauchen bei einer Erlotinib-Einnahme eine erhöhte Clearance, wodurch die Serumkonzentration erniedrigt wird.
Patienten sollte unbedingt nahegelegt werden, bei oraler medikamentöser Tumortherapie auf eine begleitende Selbstmedikation zu verzichten (siehe dazu auch Teil Grundlagen Abschnitt Wechselwirkungen) oder diese bei ihrem Arzt oder Apotheker zumindest zu erfragen.
Nebenwirkungen
Um Compliance-Probleme zu vermeiden, müssen Patienten aber ebenso auf mögliche Nebenwirkungen vorbereitet werden. So kommt es bei niedermolekularen Kinase-Inhibitoren zu anderen Toxizitäten als bei i.v. applizierten Zytostatika. Diese arzneimittelinduzierten Toxizitäten müssen als solche erkannt und zugeordnet werden können.
Hier ist an erster Stelle die Diarrhö zu nennen. Diarrhö muss definiert und dem Patienten erklärt werden, denn das Auftreten dieser Nebenwirkung hat (Handlungs-)Konsequenzen. So muss die Einnahme des die Diarrhö auslösenden Medikaments gestoppt und es muss mit der Einnahme von Loperamid nach einem festgelegten Schema begonnen werden. Weiterhin muss der behandelnde Arzt informiert werden (siehe auch Teil Nebenwirkungen Abschnitt Gastrointestinale Toxizität). Der Beratende (Arzt, Apotheker, Pflegende, PTA etc.) tut gut daran, sich davon zu überzeugen, dass der Patient das verstanden hat. Ein einfaches: „Ja“ auf die Frage „Haben Sie das verstanden?“ ist erfahrungsgemäß nicht ausreichend. Auch die „klassische“ Myelosuppression, wie sie beim Einsatz von nmKI und diversen anderen Enzym-Inhibitoren eintreten kann, oder die Kardiotoxizität diverser nmKI müssen von den in die Patientenführung eingebundenen Personen beachtet werden. Thyreotoxizität wird unter hinreichend langer Gabe diverser nmKIs gesehen. Nach der Erstbeschreibung unter Sunitinib zeigen auch unter Axitinib, Dasatinib, Imatinib, Nilotinib, Pazopanib, Sorafenib und Vandetanib thyreotoxische Effekte. Ein Klasseneffekt antiangiogener Substanzen ist eine Blutdruckerhöhung, die sekundär in einer Herzinsuffizienz münden kann, sowie die Lebertoxizität. Hepatozyten sind reich an EGF-Rezeptoren. Wird der Rezeptor durch einen EGFR-Antagonisten gehemmt, so wird auch der Transport der Gallensalze deutlich vermindert und man sieht das Erscheinungsbild eines Ikterus. Diese Rezeptorenhemmung auf Hepatozyten kann auch für den Untergang von Leberzellen verantwortlich sein, was sich durch eine zunächst asymptomatische Transaminasenerhöhung zeigt, jedoch zu einer Hepatitis führen kann. Eine Transaminasenerhöhung tritt im Übrigen relativ häufig innerhalb der ersten 3 Monate auf.
Es gilt daher – je nach Medikament – das Herz, den Blutdruck, die Leber oder zusätzlich weitere Organe zu kontrollieren, gegebenenfalls interventionell zu behandeln oder die Medikation aus- oder abzusetzen. Auch wenn der Patient das Rezept von seinem Arzt, der ihn aufklärt und unterweist, bekommen hat, so stehen die Patienten bei beginnenden Nebenwirkungen meist vor der Pflege oder in der Apotheke. Daher ist bei allen Beteiligten Sachkunde bezüglich der Patientenberatung und -unterweisung nötig und setzt das Erkennen dieser neuen, z. T. bedrohlichen Nebenwirkungen voraus.
Dennoch zeigt eine Studie, dass 96 % der Patienten, wenn sie gut beraten und gut geführt sind, ihre oralen Krebstherapien gewissenhaft und vorschriftsmäßig einnehmen [1].
Literatur
- Rough A, MacLeod A, Cassidy J et al (2004) Questionnaire audit assessing compliance in colon cancer patients (pts) taking adjuvant capecitabine (X) as part of the X-ACT trial. Ann Onk 15 (Supp 3): iii75 (Abstract 283P)
- Bailey, D.G., Dresser, G., Arnold, JMO (2013) Grapefruit–medication interactions: Forbidden fruit or avoidable consequences? CMAJ 185(4) | DOI:10.1503/cmaj.120951
1.3 Lokoregionale Applikation
1.3.1 Intraarteriell
Die intraarterielle Infusion findet z. B. Anwendung bei hepatozellulären Karzinomen, hepatischen Metastasen anderer Primärtumoren, Sarkomen und malignen Melanomen. Voraussetzung für diese Applikationsart ist ein chirurgisch angelegtes Katheter- oder Portsystem, über welches dann meist mittels einer Pumpe, die den arteriellen Druck überwinden kann, die Applikation erfolgt. Eine Spezialform der IA-CTX (intraarteriellen Chemotherapie) ist die Perfusion des Auges mit Melphalan bei Patienten mit Retinpoblastom. Diese Art der Therapie kann eine Exstirpation des Bulbus Oculi und damit eine Erblindung vermeiden.
Chemoembolisation der Leber: Zusätzlich zu den Zytostatika werden Gelatine- oder Stärkepartikel infundiert, die im Kapillarsystem der betroffenen Arterie eine temporäre Embolie ausbilden. Dadurch wird die Ausschwemmung der Zytostatika vermindert und eine höhere Tumorkonzentration und -einwirkzeit erzielt. Eine Weiterentwicklung sind mit Wirkstoff beladene Mikrosphärenkugeln, die diesen langsam freigeben, sog. DC Beads, für die transarterielle Chemoembolisation (TACE). Die derzeit gängigsten Beads enthalten Doxo-/Epirubicin oder Irinotecan (siehe auch Teil Grundlagen Abschnitt Weitere Chemotherapieformen).
Gliedmaßenperfusion: Bei der Gliedmaßenperfusion wird ein lokaler Tumorbezirk innerhalb einer Extremität über eine Art extrakorporalen Kreislauf kontinuierlich mit Zytostatika durchspült, wobei das venöse Blut gesammelt und nach Aufarbeitung arteriell wieder zugeführt wird. Dabei wird das Blut mit den Zytostatika aufgeheizt (siehe Teil Grundlagen Abschnitt Hyperthermiebehandlung).
1.3.2 Chemosaturation/Chemofiltration
Bei der Chemosaturation mit Chemofiltration handelt es sich um eine Organperfusion mit bis zu 100-facher Zytostatikadosis i. Vgl. zur sytemischen Therapie. Salopp gesprochen handelt es sich um eine lokoregionale Therapie mit Absaugung, wobei nach der Perfusion eine Chemofiltration der CTX und Elimination aus dem Körper erfolgt.
Folgende Organe und Körperteile können chemosaturiert werden:
- Extremitäten (Arm, Bein)
- Brustkorb (Lungen, Thoraxwand und Kopf)
- Abdomen (Bauch)
- Becken
- Leber
Als ein weiteres Beispiel der lokoregionalen CTX sei an dieser Stelle noch die ITP-F = Isolierte Thoraxperfusion mit Chemofiltration, wie sie z. B. beim Pleuramesotheliom zur Anwendung kommt, erwähnt.
Hilfsmittel zur intraarteriellen Infusion/Perfusion: Die intraarterielle Perfusion erfolgt unter Druck mittels eines sogenannten Perfusors. In diesen wird eine Perfusorspritze eingespannt. Damit ist eine bestimmte Infusionsrate programmierbar und eine kontinuierliche Infusion auch gegen den arteriellen Druck möglich. Grundsätzlich ist mittels eines Perfusors eine kleinvolumige (50–60 ml) infusionsratengesteuerte (Dauer-)Infusion möglich.
1.3.3 Intraperitoneal
Bei einer Peritonealkarzinose oder Karzinose des Bauchfells (Carcinosis peritonei oder Peritonitis carcinomatosa) haben bösartige Tumorzellen das Bauchfell (Peritoneum) flächig befallen. In der Regel handelt sich dabei um Metastasen anderer im Bauchraum gelegener Tumore oder es sind Tumore mit Begrenzung auf den Bauchraum, wie z. B. das Ovarialkarzinom, kolorektale Tumore, Mesotheliome und Melanome. Die Zytostatika sollen sich möglichst gleichmäßig in der Bauchhöhle verteilen, um alle Tumorzellen zu erreichen. Peritoneale Verwachsungen sind daher eine Kontraindikation für eine i.p. Gabe. Die Wirkstoffe verweilen für eine gewisse „Spülzeit“ in der Peritonealhöhle und werden nach dieser Einwirkzeit entfernt.
Merke: Solange die Peritonealkarzinose besteht, gelangen die Zytostatika auch in den systemischen Kreislauf und können dort typische Nebenwirkungen und Organschäden verursachen (z. B. Nephrotoxizität durch i.p. Cisplatin).
Der Zugang in das Peritoneum erfolgt entweder über einen Tenckhoff-Katheter oder über ein Portsystem. Die zu applizierenden Arzneimittel werden in großen Volumina (1–2 Liter) gelöst oder den körperwarm laufenden Infusionen im Bypass zugespritzt. Die heutzutage am häufigsten intraperitoneal eingesetzten Substanzen sind:
- Cisplatin
- Mitomycin C
- Doxorubicin
- Carboplatin
- Oxaliplatin
1.3.4 Hypertherme intraperitoneale CTX – HIPEC und PIPAC
1.3.4.1 HIPEC
Die intraperitoneale Gabe von Zytostatika unter erhöhter Temperatur (39–45°C) wird als HIPEC bezeichnet. Sie kann als offenes oder geschlossenes Verfahren durchgeführt werden.
Durch die Hyperthermie wird das Tumorgewebe ebenfalls erwärmt, und es kommt zu einer erhöhten Empfindlichkeit des Tumorgewebes gegenüber dem Zytostatikum. Ein weiterer Effekt der Hyperthermie soll sein, dass Tumorzellen dadurch vom Immunsystem des Körpers besser erkannt und durch Abwehrmechanismen bekämpft werden können. Auch bei der HIPEC erfolgt eine Drainage nach einer gewissen Einwirkzeit.
1.3.4.2 PIPAC
Bei der hyperthermen intraperitonealen Druck-Aerosolchemotherapie PIPAC (Pressurized Intraperitoneal Aerosol Chemotherapy) werden die Zytostatika im geschlossenen Bauchraum vernebelt.
Man kann die PIPAC auch als geschlossene HIPEC unter Aerosolierung bezeichnen. Durch dieses Vernebeln erhofft man sich eine bessere/optimierte intraabdominelle Arzneistoffverteilung. Durch Aufblähen des Bauchraums mit Luft oder CO2 kann der Abstand zusammen liegender / eng anliegender Organe vergrößert werden und eine optimale Dispergierung der Wirkstofflösungen erreicht werden. Für die Pleurakarzinose kann ein der PIPEC analoges Verfahren angewendet werden. Es wird als PITAC (Pressurized Intrathoracic Aerosol Chemotherapy) bezeichnet.
Hilfsmittel zur intraperitonealen Gabe: Tenckhoff-Katheter, Portsystem, Infusionszubehör (Zu-, Ablaufkatheter), hypertherme Pumpe (HIPEC/PIPEC) Vernebler, Luft-/Gas-Insufflator (PIPEC).
1.3.5 Intrathekal, intraventrikulär
Die Indikation einer intrathekalen Gabe ist primär die Prophylaxe (gegebenenfalls die Therapie) von ZNS-Metastasen vor allem bei Leukämien (Meningiosis leucaemica, Meningo-encephalomyelopathica leucaemica). Die Blut-Hirn-Schranke ist für die meisten Zytostatika nicht oder zumindest nicht nennenswert passierbar. Die Applikation erfolgt in der Regel in Form einer Lumbalpunktion (LP) zwischen dem 4. und 5. Lendenwirbel (Abbildung unterhalb). Mittlerweile weiß man, dass Substanzen wie Topotecan die Blut-Hirn-Schranke passieren können und damit auch systemisch ihre Wirksamkeit entfalten können.

Für planbare, häufige Lumbalpunktionen kann ein sogenanntes Ommaya-Reservoir gelegt werden. Es handelt sich um ein Ventrikelkathetersystem mit Katheterzugang in einen Seitenventrikel des Gehirns.
Bei der intrathekalen Gabe werden Volumina bis zirka 2 ml gut vertragen. Bei größeren Volumina muss vor der Applikation eine entsprechende Menge an CSF entnommen werden. Wegen der Gefahr neurotoxischer Nebenwirkungen ist auf Abwesenheit von Konservierungsmitteln in den Zytostatika-/Arzneimittellösungen zu achten. Substanzen zur intrathekalen Applikation sind Cytarabin, Methotrexat sowie Kortikosteroide wie Dexamethason oder Prednisolon (keine Kristallsuspensionen!).
Hilfsmittel zur intrathekalen Gabe: Spinalkanüle, Spritzen (meist Tuberkulinspritzen)
1.3.6 Intravesikal
Indikation ist das oberflächliche Blasenkarzinom, adjuvant zur Chirurgie oder auch in der palliativen Situation. Die Applikation erfolgt als Instillation über einen Blasenkatheter. Die Lösung sollte zirka 1–2 Stunden in der Blase verbleiben (~ 30–60 ml!) und unter Lageveränderung des Patienten sollte für eine gute Verteilung in der Blase gesorgt werden. Die wichtigsten Substanzen zur intravesikalen Applikation sind:
- Mitomycin C
- BCG-Vakzine
- Doxorubicin
- Epirubicin
Hilfsmittel zur intravesikalen Gabe: Blasenkatheter
1.3.7 Topische Applikation auf die Haut
Zur topischen Applikation gibt es derzeit nur drei Präparationen in Deutschland.
Efudix® (Fluorouracil) ist als Salbe zur Behandlung von prämalignen Veränderungen und oberflächlichen Basaliomen in strahlengeschädigter Haut indiziert, deren Lokalisation oder Ausdehnung eine Bestrahlung oder Operation problematisch erscheinen lässt.
Imiquimod ist ein Immunmodulator, der, neben äußerlichen Feigwarzen, die Zulassung gegen kleine superfizielle Basalzellkarzinome bei Erwachsenen sowie klinisch typische, nicht hyperkeratotische, nicht hypertrophe aktinische Keratosen im Gesicht oder auf der Kopfhaut bei immunkompetenten Erwachsenen hat, wenn die Größe oder die Anzahl der Läsionen die Wirksamkeit und/oder die Akzeptanz einer Kryotherapie begrenzen und andere topische Behandlungsmöglichkeiten kontraindiziert oder weniger geeignet sind. Imiquimod zerstört die Viren und Krebszellen nicht, sondern aktiviert das Immunsystem der Haut. Qualitativ beobachtet man eine provozierte Entzündungsreaktion. Diese wird vermutlich über den sog. Toll-like-Rezeptor 7 (TLR7) vermittelt. TLR7 ist ein Oberflächenmolekül von Immunzellen, insbesondere von Makrophagen. Der genaue Wirkmechanismus ist jedoch noch nicht vollständig geklärt. In vitro stimuliert Imiquimod auch die Produktion von Zytokinen durch Makrophagen und andere Immunzellen. In erster Linie werden die Zellen zur Synthese von Interferon (IFN-α), Interleukin-12 (IL-12) und Tumornekrosefaktor (TNF-α) angeregt. Außerdem soll Imiquimod die Umwandlung von naiven T-Helferzellen in Th1-Effektorzellen unterstützen. Im Effekt ergibt sich eine antivirale und antitumorale Aktivität.
Chlormethin (Syn. Mechlorethamin, Stickstoff-Lost, N-Lost) war einer der ersten zugelassenen zytostatischen Wirkstoffe. Die Substanz ist sehr reaktiv (die Injektionslösung hält max. 1 h!) und gefürchtet bei Paravasation. Als Senfgasabkömmling ist sie blasenziehend und nekrotisch. Chlormethin ist als Mustargen® Ende der 1990er-Jahre vom deutschen Markt verschwunden. Im Jahr 2017 hat es als tiefgefrorenes Gel (minus 15 bis minus 25°C) zur topischen Behandlung von kutanem T-Zell-Lymphomen des Typs Mycosis fungoides bei Erwachsenen (MF-CTCL) eine europäische Zulassung erhalten. Pro Gramm Gel sind 160 µg des Alkylans enthalten. Nach dem Auftauen des Gels ist dieses bei 2–8°C 60 Tage lang stabil. Chlormethin verursacht bei Hautkontakt Reizungen. Schleimhäute oder die Augen dürfen damit nicht in Kontakt kommen. Ein direkter Augenkontakt verursacht Schmerzen, Brennen, Entzündungen, Photophobie und Sehstörungen. Es können Erblindung und schwere irreversible Augenschäden des vorderen Augenabschnitts auftreten. Patienten sollen sich das Gel auf die CTLC-Läsionen schmieren und müssen sich danach gründlich die Hände waschen. Bis das Gel getrocknet ist, dürfen die Patienten nicht in die Nähe von Feuer oder Flammen kommen und sie dürfen nicht rauchen. Das ungetrocknete Gel ist entzündlich. Pflegende werden angewiesen, zur Applikation Einmalhandschuhe aus Nitril zu verwenden.
Hilfsmittel zur topischen Applikation: Schutzhandschuhe, Spatel
1.4 Abschließende Bemerkungen zu Infusionen
Es sollte mittlerweile Standard sein, Infusionsbestecke mit Trägerlösung zu entlüften und auch nachzuspülen. Durch Beschickung des Infusionsbestecks mit inerter Trägerlösung und folgendem Anstechen der Zytostatikainfusion wird die Gefahr des „Kleckerns“ mit Zytostatika auf Haut, Kleidung oder Gegenstände umgangen (Personen- und Umgebungsschutz). Der Rauminhalt von 20 ml/Infusionsbesteck ist ein realistischer Wert. Wird z. B. eine Kurzinfusion von 100 ml Volumen mit Infusionsbesteck ohne Nachspülen vom Patienten getrennt, ist dieser um 20 % unterdosiert! Eine Dosierungsrundung von ± 5 % liegt im üblichen Toleranzbereich. 10 % Dosisabweichung vom Soll macht sich klinisch bemerkbar. 20 % liegen außerhalb der Toleranz jeglicher Qualitätskriterien. Durch das Nachspülen der Infusionsbestecke kommt der Patient näher an seine 100-%-Solldosis und es fällt weniger Sondermüll an. Mit ein wenig Training lassen sich aber die genannten Probleme umgehen. Hier sei folgende Handhabung vorgeschlagen:
- Tropfregler ganz zudrehen
- (leeren) Infusionsbeutel oder Flasche vom Infusionsständer nehmen
- Flasche oder Beutel wenden, sodass diese nicht tropfen können
- Infusionsbesteck diskonnektieren und Flasche oder Beutel in vorher bereitgestellten Entsorgungsbehälter entsorgen
- am Einstichdorn eventuell anhaftende Flüssigkeitstropfen mit einer sterilen Kompresse abwischen und diese entsorgen
- die vorher bereitgestellte und desinfizierte Trägerlösungsflasche (Inhalt von 100 ml ausreichend) mit dem Infusionsbesteck einstechen
- Infusionsbesteck mit dieser Trägerlösung spülen (Entlüftung nicht notwendig, da noch mit einer Restmenge der Zytostatikalösung befüllt, siehe oben)
- nach Infusionsende ungetrennt entsorgbar (höchstens niedrig kontaminiert)
Der Vollständigkeit halber bliebe noch zu erwähnen, dass für diverse Zytostatika oftmals eine Venenspülung obligat ist (z. B. Vinorelbin, Anthrazykline). Mittlerweile gibt es auch Infusionsbeutel mit integriertem Infusionsschlauch. Diese Systeme entleeren sich vollständig „patientennah“, es verbleiben minimale Mengen an Restlösung im System. Zur Applikation von (obligaten) Spüllösungen muss immer das gesamte System gewechselt werden. Eine weitere Möglichkeit, Zytostatikaverwurf zu minimieren, ist die Verwendung von Multi-Zugang-Infusionssystemen. Die Zytostatikainfusionen können komplett leerlaufen und ohne Umstecken oder Systemtrennung kann mit Trägerlösung nachgespült werden (Abbildung unterhalb).
Das oben beschriebene Verfahren des Umsteckens ist aus Personenschutzgründen von der Berufsgenossenschaft (BGW) nicht gern gesehen. Verbleibende Reste sind jedoch therapeutisch relevant (siehe auch Der vergessene Rest – Totvolumina bei Kurzinfusionen, in: Bulletin zur Arzneimittelsicherheit, Ausgabe 2, Juni 2015 [https://www.bfarm.de/SharedDocs/Downloads/DE/Arzneimittel/Pharmakovigilanz/Bulletin/2015/2-2015.html; aufgerufen am 23.2.2021]). Eine technische Lösung stellen die erwähnten Multi-Access-Systeme oder Piggyback-Infusionen dar. Hierbei handelt es sich um eine Sekundärinfusion, die nur die Spüllösung (gleiche Trägerlösung wie die des Arzneistoffs) enthält. Die Piggyback-Infusion wird über ein Y-Stück an die Infusionsleitung der Primärinfusion (Arzneimittelinfusion) angeschlossen. Diese kann bis zum Verbindungsstück ganz leerlaufen. Nach Abschluss der Primärinfusion erfolgt das Nachspülen mittels der Sekundärinfusion, ohne dass ein Umstecken nötig ist. Sofern korrekt durchgeführt, ist dieses Nachspülen die beste Methode, um einen Wirkstoffverlust im Sinne einer Unterdosierung vorzubeugen. Darüber hinaus verbleibt ein minimal mit Wirkstoff belastetes Infusionsbesteck anstatt einer hoch konzentrierten Wirkstofflösung.

1.5 Applikation von Zytostatika unter pflegerischem Aspekt
Mirko Laux, Sabine Gärtner, Rolf Bäumer, Rita Bodenmüller-Kroll
Die Anwendung von Katheter-, Port- und Pumpensystemen soll von Pflegenden sicher durchgeführt werden können, da Probleme in der fachgerechten Durchführung der ärztlich angeordneten Therapien fatale Folgen für die Patienten nach sich ziehen können. Außerdem hat das Pflegepersonal auch häufig die Schulung des Patienten für die häusliche Versorgung zu übernehmen. Sie müssen dem Patienten, Angehörigen oder ambulanten Pflegekräften die Handhabung und den Gebrauch der Systeme in verständlicher Form erklären und Hilfestellung bei Problemen leisten.
Im Umgang mit Katheter- und Pumpensystemen sollten sich Pflegende Kenntnisse im Gebrauch der Systeme aneignen, Standards und Richtlinien zur Handhabung entwickeln und einhalten und die Information und Schulung von Patienten übernehmen und überprüfen.
1.5.1 Zentralvenöse Kathetersysteme
Vorteile von venösen Kathetersystemen sind:
- weniger schmerzhafte Venenpunktionen
- Vermeidung strangförmiger Verhärtungen der Venen
- verbesserte Mobilität des Patienten
- verkürzte Krankenhausaufenthalte
- Steigerung der Lebensqualität
- ambulante Behandlung möglich
Indikationen aus therapeutischer Sicht sind:
- schlecht zugängliche oder vorgeschädigte Venen
- voraussichtlich längere zytostatische Therapie
- dosisintensivierte Chemotherapie
- intravenöse Schmerztherapie
- parenterale Ernährung
- Antibiotika-/Antimykotikatherapie
- Transfusionen
- häufige diagnostische Blutentnahmen
Unter den zentralvenösen Kathetern kommt dem ZVK (Subklavia-Jugularis-Katheter) die wichtigste Rolle zu. Er ermöglicht Behandlungskonzepte, die über periphere Venen nur schwer möglich wären. Die Anlage erfolgt nach Aufklärung des Patienten durch den Arzt, das Pflegepersonal leistet Unterstützung zum Abbau von möglichen Ängsten. Nach der Anlage erfolgt die Lagekontrolle mittels Sonografie oder Röntgen. Der sterile Verbandwechsel an der Hauteintrittstelle wird alle 1–2 Tage je nach Standard der Abteilung durchgeführt.
Grundsätzliches:
- täglich Inspektion des Verbandes
- bei Fixomull®-Verband: täglich Inspektion und Palpation der Einstichstelle
- bei Patienten mit Bewusstseinstrübung, Neutropenie, Immunsuppression: täglich Verbandwechsel
- Verbandwechsel bei Verschmutzung, Durchfeuchtung und Ablösung des Verbandes oder alle 7 Tage
- alle Einstichstellen werden unter sterilen Bedingungen verbunden (Non-Touch-Technik oder sterile Handschuhe)
- nicht über der Einstichstelle sprechen, da es zu Keimbesiedlung kommen kann
- Händedesinfektion
- Hautdesinfektion
- bei Druckschmerz, Fieber, unklarer Genese oder Sepsis: Verband entfernen und Inspektion der Einstichstelle
- bei Infektionszeichen: Zugang nach Rücksprache mit dem Arzt entfernen und dokumentieren
- bei Sekretaustritt/Belag: Wundabstrich in Absprache mit dem Arzt
- Bei Verbänden mit Biopatch®(Chlorhexidingetränkte Plättchen) kann der Verbandwechsel nach 5–7 Tagen erfolgen, die tägliche Inspektion und Druckdolenzprüfung wird beibehalten.
Material:
Folienverband, sterile Watteträger oder sterile Kompressen, Tupfer, sterile Pinzette und Schere oder sterile Handschuhe, Einmalhandschuhe, Hautdesinfektionsmittel, Händedesinfektionsmittel, Abwurf
Durchführung:
- Händedesinfektion
- Einmalhandschuhe anziehen
- Verband abnehmen, danach Handschuhe ausziehen
- Händedesinfektion
- Hautdesinfektion
- mit sterilem Watteträger Einstichstelle säubern (von der Einstichstelle nach außen wischen)
- neuen Verband anbringen
- bei nicht angenähtem ZVK Zügel anlegen
Merke:
- Haut- und Händedesinfektion laut Herstellerangaben der angewendeten Desinfektionsmittel
- bei gesichtsnahen Verbänden Patienten vor dem Einatmen alkoholischer Desinfektionsmittelaerosole schützen
- bei Verwendung anderer Verbandstoffe entsprechende Dokumentation
- kein Aufbringen von antibakteriellen Salben
Grundsätzlich sind alle Manipulationen am System unter strenger Beachtung der Antiseptik durchzuführen. Vor jeder Manipulation sollte eine Inspektion der Einstichstelle auf Rötung/Sekretaustritt erfolgen.
Die Spülung des ZVK wird wie folgt durchgeführt:
- hygienische Händedesinfektion
- sterile Handschuhe anziehen
- Tupfer unterlegen, Katheterschenkel abklemmen, Verschlusskonus entfernen
- Katheteransatzstück mit alkoholischem Desinfektionsmittel einsprühen
- Katheterblockung mit 5-ml-Spritze abziehen
- Spüllösung pro Katheterschenkel
- 1 Spritze mit 10 ml NaCl 0,9 %
- 1 Spritze mit mindestens 5 ml physiologischer Kochsalzlösung (Kein Heparin! Cave: HIT II)
- Katheter abklemmen, neuer Verschlusskonus
Wichtig ist, dass nur 5-ml- bzw. 10-ml-Spritzen verwendet werden. Wird der ZVK nicht genutzt, erfolgt eine Spülung jeweils nach Blutentnahme. Nach Blutentnahme soll mit 20 ml NaCl 0,9 % gespült werden.
Bei Infektionszeichen muss der Arzt informiert werden. Keine Spülung bei Widerstand im Katheter.
Zum Gebrauch des Systems wird ein 3-Wege-Hahn montiert, dieser wird wie alle anderen Infusionssysteme alle 24 Stunden gewechselt.
Die Katheterinfektion ist eine der häufigsten Komplikationen, deren Entstehung auch durch nicht sterile Handhabung entstehen kann. Anzeichen sind Fieber und Schüttelfrost bis hin zum septischen Schock. Der Patient sollte engmaschig überwacht werden; es erfolgt eine Blutabnahme für periphere und zentrale Blutkulturen; sofortige systemische Gabe von Antibiotika ist angezeigt und bei bestehender Symptomatik trotz Antibiotikawechsel muss ein Entfernen des Kathetersystems in Betracht gezogen werden.
Die Venenthrombose entsteht durch nicht zentrale Lage des Katheters, bei erhöhter Thromboseneigung eines Patienten und durch die Verabreichung ätzender Substanzen. Anzeichen sind eine Schwellung des Armes, eine livide Verfärbung und die Bildung eines Umgehungskreislaufes. Aspiration und Injektion sind nicht mehr möglich. Die Behandlungsmöglichkeiten sind Heparinisierung, Fibrinolyse, eine chirurgische Thrombektomie und die Entfernung des Systems.
Die Embolie entsteht durch einen Thrombus oder Luft, der Patient reagiert mit Dyspnoe, Unruhe, Tachykardie, thorakalen Schmerzen, Schocksymptomatik bis hin zum Herz-Kreislauf-Stillstand. Intensive Überwachung des Patienten, Bettruhe, Analgesie und eventuell Sedierung, Gabe von Sauerstoff, Heparinisierung oder eine Lysetherapie sind hier sofort einzuleitende Maßnahmen.
Bei der Dislokation liegt der Katheter nicht mehr zentral, Aspiration und Injektion sind nicht mehr möglich, eventuell liegt eine Armschwellung vor. Die adäquate Maßnahme liegt hier im Katheterwechsel.
1.5.2 Implantierbare Systeme – venöses Portsystem
Die Entscheidung für oder gegen ein implantierbares Kathetersystem muss individuell beurteilt und mit jedem Patienten besprochen werden. Die Akzeptanz des Systems durch den Patienten ist Voraussetzung zur Anlage eines Portsystems. Der Vorteil gegenüber zentralvenösen Kathetern, die aus der Haut austreten, liegt sicher in der längeren Liegezeit des Systems, dem deutlich besseren kosmetischen Ergebnis, der Erhöhung der Bewegungsfreiheit und dem komplikationslosen Umgang beim Nichtgebrauch des Systems.
Zur Verbesserung der Patientenakzeptanz sind bei verschiedenen Firmen Patientenbroschüren zur Information erhältlich, hilfreich kann auch die Herstellung eines Kontaktes zu Mitpatienten sein, die bereits ein solches System tragen.
Die Aufklärung über die Anlage des Systems erfolgt durch den betreuenden Arzt, aber gerade hier haben die Pflegekräfte einen entscheidenden Anteil am zusätzlichen Informationsbedarf des Patienten zum Umgang mit dem System und zum Abbau eventueller Ängste und Vorbehalte.
Die Anlage des Portsystems erfolgt in Lokal- oder Vollnarkose, die postoperative Versorgung erfordert einen täglichen sterilen Verbandwechsel bis zum Entfernen der Nähte. Unter Umständen kann es zu Wundschmerz oder Druckschmerz nach der Anlage kommen; dies sollte aber spätestens nach einer Woche rückläufig sein. Bei einer Hämatombildung an der Operationsstelle sollte mit dem Gebrauch des Systems längere Zeit gewartet werden. Zur reizloseren Abheilung wird das System erst nach der vollständigen Wundheilung verwendet, es kann aber, je nach medizinischer Notwendigkeit, auch sofort benutzt werden. Nach der Anlage erhält der Patient einen Ausweis, der ihn als Träger eines implantierten Kathetersystems ausweist und ihn damit auch von der Anschnallpflicht beim Autofahren befreit.
1.5.3 Portsystem anstechen
Grundsätzlich gilt auch hier, dass alle Manipulationen am Portsystem unter strenger Beachtung der Antiseptik durchzuführen sind. Vor jeder Manipulation am Port erfolgt eine Inspektion der Einstichstelle auf Rötung/Sekretaustritt. Es sollten nur 10-ml- oder 20-ml-Spritzen verwendet werden. Eine langsame Injektionsgeschwindigkeit ist zu empfehlen, da ansonsten die Gefahr der Diskonnektion oder Ruptur des Systems besteht. Die Liegedauer der Portnadel variiert je nach Herstellerangaben, sollte aber 7–10 Tage nicht überschreiten.
Material: Händedesinfektionsmittel, Hautdesinfektionsmittel, sterile Handschuhe, Portnadel (19 G, Länge 19 mm, 25 mm oder 32 mm), 10-ml- oder 20-ml-Spritze, NaCl 0,9 %, Kombi-Stopper und Verbandmittel für einen aseptischen Verband
Durchführung:
- Information des Patienten, Sitz-/Liegeposition einnehmen lassen
- Händedesinfektion durchführen
- Durchführung der Hautdesinfektion
- Portnadelverpackung steril öffnen und System mit NaCl 0,9 % füllen, Spritze am System belassen
- sterile Handschuhe anziehen
- Portkammer tasten, mit drei Fingern fixieren und mit der anderen Hand anstechen (bei korrekter Lage der Nadel ist ein Klick zu hören, wenn die Nadelspitze die Bodenplatte berührt)
- Portsystem mit mindestens 5 ml NaCl 0,9 % spülen
- Aspirationsversuch mit belassener Spritze, anschließend mit 40 ml NaCl 0,9 % spülen
- Infusion anschließen oder Portsystem abstöpseln
Die Kriterien zur Auswahl der Portnadel sind wie folgt:
- Länge der Nadel
- Stärke der Nadel
- Art und Umfang der Maßnahme
- Laufzeit der zu verabreichenden Substanz
- Viskosität der zu verabreichenden Substanz
- Zustand des Patienten
Wichtig: Bei Verdacht auf Infektion/Portverschluss ist Rücksprache mit dem Arzt zu halten.
Die Portspülung erfolgt mittels 20 ml NaCl 0,9 % und sollte vor und nach jeder Injektion/Infusion durchgeführt werden. Zum Schluss wird die Portklemme während des letzten Milliliters unter Druck geschlossen. Wird das Portsystem nicht genutzt, sollte es alle 4–8 Wochen gespült werden.
Das Blocken des Ports mit Heparin wird in der Literatur kontrovers diskutiert. Es gibt jedoch keinen wissenschaftlichen Hinweis, dass ein Spülen mit Heparin Vorteile gegenüber den Spülvorgängen nur mit NaCl 0,9 % hat. Cave: HIT II durch Heparin. Auch praktische Erfahrungen haben gezeigt, dass ein Blocken mit Heparin nicht erforderlich ist, sofern die Portspülung sachgerecht und mit einer entsprechenden Menge NaCl 0,9 % erfolgt. Die Menge richtet sich unter anderem nach der zuvor infundierten Lösung. Nach der Applikation von Blutprodukten oder Ernährungsinfusionen sollte unter Umständen mit mehr als 20 ml NaCl 0,9 % gespült werden. Wichtig ist es, dass die internen Standards eingehalten werden und Patienten nicht dadurch verunsichert werden. Eine einheitliche Vorgehensweise sollte diskutiert und umgesetzt werden.
Komplikationen
Die Komplikationen ähneln denen des zentralvenösen Katheters.
Die Ursachen von Diskonnektion und Katheterruptur liegen meist an der Spülung der Systeme mit zu hohem Druck. Anzeichen sind Schmerzen und Schwellung am Port bei Injektion oder Infusion. Nach der Entfernung der Nadel erfolgt hier eine sofortige chirurgische Intervention.
Ein Membrandefekt entsteht durch die Anwendung einer nicht geeigneten oder defekten Portnadel oder bei über 2.000 Punktionen, was aber äußerst selten ist. Symptome sind wie beim Paravasat Schmerzen, Schwellung und Rötung über dem Port bei der Injektion oder Infusion. Beim Auftreten dieser Symptome die laufende Infusion sofort unterbrechen, die Lage der Portnadel überprüfen, das Portsystem mit Kontrastmittel im Röntgenbild darstellen, um das Leck zu lokalisieren; danach chirurgische Intervention.
Ursachen einer Infektion an der Einstichstelle sind meist eine Dauertherapie oder eine unsaubere Arbeitsweise. Bei gering ausgeprägter Entzündung wird die Einstichstelle versetzt und es werden lokale Maßnahmen, wie Wundreinigung und Salbenverband, eingesetzt. Bei großflächigen Entzündungen Portnadel entfernen, Port nicht benutzen, lokale Maßnahmen und eventuell antibiotische Behandlung.
Infektionen der Portkammer und des Portkatheters treten häufiger in der Zeit der Neutropenie nach erfolgter Chemotherapie auf, können aber auch Ursache einer unsauberen Arbeitsweise sein. Ein sicheres Anzeichen sind subfebrile bis septische Temperaturen kurze Zeit nach der Portbenutzung. Zur Keimbestimmung werden Blutkulturen sowohl aus dem Katheter wie auch peripher abgenommen, es erfolgt eine systemische Antibiose über den Port. Bei Katheterinfektionen kann außer den systemischen Antibiotika ein wiederholter Antibiotikablock in das Portsystem erfolgreich sein. Bei bestehender Symptomatik wird das System eventuell entfernt.
Bei der Nutzung implantierter Portsysteme ergeben sich für das Pflegepersonal viele Aufgaben. Um die oben erwähnten Komplikationen teilweise zu vermeiden, sind Richtlinien im Umgang mit diesen Systemen erforderlich, diese müssen ständig überprüft und eingehalten werden.
Da die implantierbaren Systeme auch teilweise von Patienten und Angehörigen gehandhabt werden, kann die gewünschte Patientenunabhängigkeit nur dann erfolgreich praktiziert werden, wenn frühzeitig, möglichst postoperativ, mit der Schulung von Patienten und ihren Angehörigen begonnen wird und ein kompetenter Ansprechpartner bei Problemen immer zur Verfügung steht.
1.5.4 PICC-Line-Katheter
Eine Alternative zu ZVK und Portkathetern stellt der peripher eingeführte zentralvenöse Katheter PICC-Line dar (peripherally inserted central venous catheter). Dieser wird unter Ultraschallkontrolle und örtlicher Betäubung über eine Armvene eingeführt, meistens knapp oberhalb der Ellenbeuge. Von dort wird der Katheter unter Durchleuchtungskontrolle bis in die große Hohlvene vorgeführt. An der Einstichstelle bleibt das Anschlussteil des Katheters sichtbar, wird an der Haut mit speziellen Systemen fixiert und steril verbunden.
Ein PICC kann bis zu vier Monate, bei guter Pflege aber auch länger benutzt werden. Im Gegensatz zum ZVK kann beim PICC genau wie beim Port die zentralvenöse Therapie auch ambulant durchgeführt werden. Im Gegensatz zum Port erfolgt beim PICC keine Punktion durch die Haut. Der PICC ist darüber hinaus auch für die Blutabnahme geeignet. Bei sorgfältiger Pflege (wie beim ZVK) sind Infektionen des Katheters sehr selten. Das Duschen ist mithilfe eines speziellen Verbandes möglich. Ob sich dieser Katheter auch in der Onkologie etablieren wird, ist zurzeit noch nicht vorhersehbar.
1.5.5 Pumpensysteme
Indikationen für den Einsatz von Pumpen sind neben der wiederholten, zeitgenauen Applikation von Zytostatika vor allem die kontinuierliche Schmerztherapie, die Substitution von Elektrolyten, die Verabreichung von Antibiotika und Antimykotika, Insulin-Dauertherapie und die parenterale Ernährung (siehe Abschnitt Systemische Applikation).
Anforderungen an die Pumpen und Voraussetzung für ihren Einsatz:
- Sicherheit, Genauigkeit
- Netzunabhängigkeit
- Handlichkeit, Bedienerfreundlichkeit
- Kosten-Nutzen-Relation
- ausreichende Herstellerinformation
- Schulung der Anwender
- Beachtung der MedGV
Vor Einführung eines Pumpensystems müssen genaue Informationen und Schulungen durch den Hersteller erfolgen, die dann intern im Schneeballsystem weitergegeben werden. Bei verschiedenen Geräten müssen die MedGV-Vorschriften beachtet, dies regelmäßig kontrolliert und schriftlich festgehalten werden.
Wichtig sind die Leistungen der Hersteller von Pumpen: in verständlicher Sprache abgefasste Unterlagen, direkte Instruktionen des Pflegepersonals durch den Hersteller, Schulungsangebote und Informationsbroschüren auch für Patienten.
Je sicherer das Pflegepersonal im Umgang mit Pumpen ist, je besser sich die Zusammenarbeit zwischen dem ärztlichen und pflegerischen Bereich darstellt, umso besser wird auch die Anleitung von Patienten im Umgang mit dieser Technik sein. Das Vertrauen des Patienten zu Arzt und Pflegenden, das Vertrauen in die Technik, aber auch die Zuverlässigkeit des Patienten und seine Kenntnisse über Art der Therapie und deren Ablauf spielen hier eine große Rolle.
Die Schulung und Beratung des Patienten erstreckt sich über das Starten der Pumpe, das Wechseln des Reservoirs und das Lösen einfacher Probleme. Bei Störungen in der Abgabe des Medikamentes muss dies für den Patienten ersichtlich sein und er braucht einen Ansprechpartner über ein 24-Stunden-Notfalltelefon. Das Erlernen der Handhabung von Pumpen für den ambulanten Bereich ist sicher oft sehr zeitintensiv für das therapeutische Team. Diese Zeit einzuplanen ist aber sinnvoll, da viele Pumpensysteme die Selbstständigkeit und Unabhängigkeit des Patienten fördern und somit die Lebensqualität erhöhen können.
Literatur zum Umgang mit Portsystemen
- Asmis, L. M.; Bösiger, J.; Fehr, J. (2004): Heparin-induzierte Thrombopenie (HIT). In: Schweiz Med Forum 4, S. 997–1002
- Bradford, Natalie K.; Edwards, Rachel M.; Chan, Raymond J. (2020): Normal saline (0.9 % sodium chloride) versus heparin intermittent flushing for the prevention of occlusion in long-term central venous catheters in infants and children. In: The Cochrane database of systematic reviews 4, CD010996. DOI: 10.1002/14651858.CD010996.pub3
- Frank, U. (2007): Heparininduzierte Thrombozytopenie HIT Typ I und II. Hg. v. Kantonsspital. Graubünden
- López-Briz, E.; Ruiz Garcia, V.; Cabello, Juan B.; Bort-Martí, S.; Carbonell Sanchis, R.; Burls, A. (2018): Heparin versus 0.9 % sodium chloride locking for prevention of occlusion in central venous catheters in adults. In: The Cochrane database of systematic reviews 7, CD008462. DOI: 10.1002/14651858.CD008462.pub3
- Sharma, S. K.; Mudgal, S. K.; Gaur, R.; Sharma, R.; Sharma, M.; Thakur, K. (2019): Heparin flush vs. normal saline flush to maintain the patency of central venous catheter among adult patients. A systematic review and meta-analysis. In: Journal of family medicine and primary care 8 (9), S. 2779–2792. DOI: 10.4103/jfmpc.jfmpc_669_19
- Xin, Y.; Rupnow, M.; Bastide, P.; Lafuma, A.; Ovington, L.; Jarvis, W. R. (2011): Economic impact of use of chlorhexidine-impregnated sponge dressing for prevention of central line-associated infections in the United States. In: American Journal of Infection Control 39 (8), S. 647–654
2 Zubereitung von Zytostatika
Irene Krämer und Vanessa Häfner
Im Umgang mit Zytostatika sind bei direktem Kontakt mit Haut- oder Schleimhäuten oder systemischer Aufnahme in den Körper schädliche Wirkungen nicht auszuschließen. Nach Art der Schädigung werden unterschieden:
- lokale Toxizität (wie z. B. Haut- oder Schleimhautreizungen)
- akute Toxizität (wie z. B. Übelkeit, Erbrechen, Haarausfall)
- Genotoxizität (krebserzeugend, erbgutverändernd, fruchtschädigend)
Die genotoxischen Eigenschaften werden auch als CMR- oder KMR-Eigenschaften bezeichnet:
- Carcinogenität oder Karzinogenität = krebserzeugende Eigenschaften
- Mutagenität = erbgutverändernde Eigenschaften
- Reproduktionstoxizität = fortpflanzungsgefährdende oder fruchtbarkeitsgefährdende (Rf) und fruchtschädigende (Re) Eigenschaften
Die genetischen Schädigungen betreffen in erster Linie schnell wachsende Zellen, wie Zellen des Magen-Darm-Traktes, Haarfollikelzellen, Keimzellen und Blutzellen. Viele klassische Zytostatika wirken direkt am genetischen Material der Zellen und haben dadurch CMR-Eigenschaften. Die in der Tumortherapie eingesetzten monoklonalen Antikörper sind als fruchtschädigend anzunehmen. CMR-Arzneimittel sind als Gefahrstoffe eingestuft und beim Umgang ist die Richtlinie TRGS 525 (Abkürzung siehe Abschnitt Arbeitsschutzrechtliche Bestimmungen) zu beachten. Neben den antineoplastischen Zytostatika sind heute auch immunmodulierende Arzneimittel unverzichtbarer Bestandteil der modernen Tumortherapie. Ob von einem Arzneimittel eine Gefahr für die Gesundheit der Beschäftigten ausgeht, ist in der Regel nicht ohne weiteres ersichtlich, da für Arzneimittel keine gefahrstoffrechtliche Kennzeichnungspflicht besteht. Doch sind diese Informationen Grundlage für eine Gefährdungsbeurteilung gemäß Gefahrstoffrecht.
Nach dem Gefahrstoffrecht sind Arbeitsbereiche in Einrichtungen der humanmedizinischen Versorgung (z. B. Krankenhaus, Arztpraxis), in denen ein Umgang mit Zytostatika erfolgt, zu erfassen und die eingesetzten CMR-Arzneimittel nach Art und Menge im Gefahrstoffverzeichnis der Einrichtung aufzuführen (erfolgt im Krankenhaus in der Regel in Zusammenarbeit mit dem sicherheitstechnischen Dienst und/oder dem Betriebsarzt). Als Arbeitshilfe für die gefahrstoffrechtliche Zuordnung empfiehlt sich das Themenheft der BGW (Berufsgenossenschaft für Gesundheitsdienst und Wohlfahrtspflege) „Gefahrstoffrechtliche Kennzeichnung von Arzneistoffen in der Tumortherapie“ (BGW 09-19-008, Stand 12/2018) [2], das sich auch von der BGW-Homepage herunterladen lässt. Das Gefahrstoffverzeichnis ist fortzuschreiben und mindestens einmal jährlich zu überprüfen. Die Liste der Arzneistoffe bietet eine Hilfestellung bei der Informationsermittlung und ist so Ausgangspunkt für die betriebliche Gefährdungsbeurteilung nach § 6 Gefahrstoffverordnung bzw. TRGS 525 (siehe Abschnitt Arbeitsschutzrechtliche Bestimmungen). Mit den angeführten Angaben zu den Arzneistoffen können unter Berücksichtigung der Expositionsbedingungen und der konkreten Arbeitsumstände vor Ort Gefährdungen ermittelt werden, um im Anschluss Schutzmaßnahmen festzulegen.
Der Umgang mit CMR-Arzneimitteln ist nach der Gefahrstoffverordnung der zuständigen Gewerbeaufsicht anzuzeigen (die Berufsgenossenschaft verzichtet auf Anzeige). Körperflüssigkeiten von Patienten mit CMR-Arzneimitteltherapien sind in der Regel nicht als Gefahrstoffe einzuordnen, da Konzentrationen von 0,1 % (ein Teil Zytostatikum auf 1000 Teile Urin, Stuhl oder Erbrochenes) nicht überschritten werden. Eine Ausnahme könnte Erbrochenes während oder kurz nach einer Hochdosistherapie darstellen.
Belastung durch Zytostatika
Die Aufnahme von Zytostatika in den Körper kann durch Einatmen, Verschlucken oder Resorption über die Haut oder Schleimhaut erfolgen. Typische Tätigkeiten, bei denen es zur Exposition und Aufnahme kommen kann, sind die Herstellung applikationsfertiger Zytostatikazubereitungen, deren Applikation (Verabreichung) am Patienten, Reinigungsarbeiten verschütteter Zytostatika, der Umgang mit Erbrochenem und Exkrementen von Chemotherapiepatienten (z. B. nach Hochdosistherapien, Erbrechen direkt nach oraler Zytostatikagabe) und die Handhabung von verunreinigten Textilien, Geräten und Flächen. Bei diesen Tätigkeiten sind daher besondere Vorsichtsmaßnahmen einzuhalten.
Auch unter Einhaltung aller Vorsichtsmaßnahmen lassen sich mit sehr empfindlichen, modernen analytischen Methoden noch Belastungen bei Beschäftigten nachweisen. Über die Bedeutung des Nachweises dieser minimalen Zytostatikamengen und die daraus resultierenden genetischen Risiken besteht keine Klarheit. Bei konsequenter Einhaltung der Schutzmaßnahmen wird die Gefährdung als gering eingestuft. Da es bis heute nicht möglich ist, verbindliche Grenzwerte für Zytostatika im biologischen Material zu definieren, werden routinemäßige Untersuchungen von Blut und Urin auf Zytostatika (Biomonitoring, Belastungsmonitoring) und sonstige spezielle arbeitsmedizinische Untersuchungen, wie z. B. Chromosomenaberrationen, als nicht zweckmäßig angesehen.
Empfohlen ist zurzeit eine Erstuntersuchung vor Aufnahme der Tätigkeit und die jährliche bis zweijährliche Nachuntersuchung z. B. nach dem berufsgenossenschaftlichen Grundsatz G 40 (krebserzeugende Gefahrstoffe allgemein) oder im Rahmen der Vorsorgeuntersuchung G 42 (Tätigkeiten mit Infektionsgefährdung). Weitergehende Untersuchungen (z. B. Belastungsmonitoring) können im Einzelfall bei großflächigem Kontakt sinnvoll sein und sind auf Verlangen durchzuführen, wenn der Beschäftigte einen ursächlichen Zusammenhang zwischen seiner Erkrankung und seiner Tätigkeit am Arbeitsplatz vermutet. Das biologische Beanspruchungs- und zytogenetische Effektmonitoring ist wissenschaftlichen Studien mit einem ausreichend großen Beschäftigtenkollektiv unter kontrollierten Bedingungen vorbehalten. Routinemäßige Untersuchungen der Arbeitsplätze auf Kontamination mit Zytostatika mittels Wischproben (Umgebungsmonitoring) sind wegen des Problems der Interpretierbarkeit der Messergebnisse und bisher nicht definierter Arbeitsschutzgrenzwerte ebenfalls nicht zweckmäßig. Sie eignen sich zur Untersuchung der Wirksamkeit von Arbeitsschutzmaßnahmen für wissenschaftliche oder exemplarische Zwecke. Das Ausmaß der Umgebungskontamination soll im Vergleich zu vorangegangenen Proben oder im Vergleich zu anderen Einrichtungen bewertet werden. Detaillierte Informationen zum Umgebungsmonitoring mit Wischproben und durchgeführte Studien finden sich im BGW-Themenheft „Zytostatika im Gesundheitsdienst“ [1].
2.1 Zubereitung
Unter Zubereiten von Zytostatika sind alle Bearbeitungsvorgänge der Fertigarzneimittel bis zum Erreichen einer applikationsfertigen Darreichungsform (z. B. Injektion, Infusion) zu verstehen. Dazu gehören das Auflösen von Trockensubstanzen in dem dafür vorgesehenen Lösungsmittel, das Aufziehen von Spritzen und die Verdünnung mit Infusionsträgerlösungen.
Die Gefährdung kann dabei entstehen durch Stäube von Zytostatika (z. B. außen an den Injektionsflaschen anhaftend, defekte Ampullenflaschen mit Trockensubstanz) sowie Verspritzungen, Verschüttungen oder Aerosolbildung von Zytostatikalösungen. Unter Aerosolen versteht man feinst verteilte, mit bloßem Auge nicht sichtbare Tröpfchen von Zytostatikalösungen in der Luft, die insbesondere beim Auflösen von Trockensubstanzen in Durchstechflaschen entstehen können. Durch Zuspritzen des Lösungsmittels und mangelnden Druckausgleich entsteht in der Flasche ein Überdruck, der beim Herausziehen der Kanüle zur Freisetzung der Zytostatikalösung in Sprayform führt (zu erkennen auch am hörbaren Zischen). Um die Gefährdung zu minimieren, ist dem zentralen Zubereiten von Zytostatika unter kontrollierten Bedingungen in der (Krankenhaus-)Apotheke Vorzug vor dem dezentralen Zubereiten in Stationsstützpunkten und Praxen zu geben. Wenn Zytostatika als Trockensubstanzen und Konzentrate verfügbar sind, sollen Letztere bevorzugt eingesetzt werden.
2.1.1 Räume
Die Herstellung von Zytostatikazubereitungen darf nur in deutlich gekennzeichneten, abgetrennten Arbeitsräumen erfolgen. Dazu kann an der Tür beispielsweise ein Schild mit der Aufschrift „Zytostatikazubereitung – Zutritt für Unbefugte verboten“ angebracht werden. Der Gefahrenbereich muss zusätzlich durch Verbotszeichen abgegrenzt werden. Größe und Luftführung des Raums müssen den sicheren Betrieb der Sicherheitswerkbank gewährleisten. Eine ausreichende Belüftung und geeignetes Raumklima ist gemäß Arbeitsstättenverordnung sicherzustellen. Fenster dürfen während der Arbeiten an der Werkbank grundsätzlich nicht geöffnet werden. Das Öffnen von Türen darf die Funktion der Werkbank nicht negativ beeinträchtigen, was der Fall ist, wenn die Sicherheitswerkbank zu nahe an der Tür steht.
Der Raum soll ausschließlich für befugtes Personal in Schutzkleidung zugänglich sein. Während der Zytostatikazubereitung sollen keine anderen Tätigkeiten im gleichen Raum ausgeführt werden und die Zahl der anwesenden Personen soll so gering wie möglich gehalten werden. Das Essen, Trinken und Rauchen ist im Herstellungsbereich verboten. Es sind geeignete Verbotszeichen dafür anzubringen. In unmittelbarer Nähe sollte eine Waschmöglichkeit vorhanden sein.
2.1.2 Sicherheitswerkbänke/Zytostatikawerkbänke
Die Zubereitung von Zytostatika hat ausnahmslos in geeigneten Sicherheitswerkbänken der Klasse 2 zu erfolgen, die den aktuellen Prüfgrundsätzen (zurzeit DIN 12980 oder gleichwertig) entsprechen und regelmäßig geprüft werden. Möglicherweise bei der Herstellung entstehende Aerosole werden durch die Hochleistungs-Schwebstofffilter in den Werkbänken abgefiltert. Die Freisetzung von Zytostatika als Zytostatikadämpfe, die nicht abfiltriert werden, wird nach heutigem Kenntnisstand als vernachlässigbar angesehen. Die Werkbänke sind sachgerecht aufzustellen, zu betreiben, zu warten und zu prüfen (detaillierte Regelungen siehe Kapitel Abschnitt Arbeitsschutzrechtliche Bestimmungen). Der sichere Betrieb ist durch eine Prüfung vor Ort nachzuweisen. Prüfungen gemäß den aktuellen Prüfgrundsätzen sind im Gerätebuch zu dokumentieren. Zuluft- und Abluftführung des Aufstellungsraumes müssen auf die Sicherheitswerkbank abgestimmt sein. Fortluftsysteme dürfen nicht direkt angeschlossen sein. Wenn Zytostatikawerkbänke im Umluftverfahren betrieben werden, darf von dem berufsgenossenschaftlich anerkannten Verfahren nicht abgewichen werden. Während des Arbeitens müssen Veränderungen der Luftströmung vermieden werden, die zu einer Einschränkung
- des Rückhaltevermögens = Austreten von potenziell mit Zytostatika kontaminierter Luft aus dem Arbeitsbereich der Werkbank,
- des Produktschutzes = Eintreten von potenziell mit Keimen verunreinigter Luft in den Arbeitsbereich der Werkbank oder
- des Verschleppungsschutzes = Querverteilung von potenziell mit Zytostatika kontaminierter Luft innerhalb des Arbeitsbereiches der Werkbank führen.
Störungen der Luftströmung können auch entstehen durch das Öffnen von Türen oder Fenstern, das Verdecken der Lüftungsschlitze in der Arbeitsplatte, das Einbringen voluminöser Gegenstände oder Geräte mit starker Eigenbewegung, das Überladen mit Gegenständen sowie schnelle Hand-, Arm- oder Körperbewegungen der Bedienungsperson.
Für das Arbeiten an den Sicherheitswerkbänken ist eine Betriebsanweisung gemäß TRGS 555 zu erstellen. Das Arbeiten an der Sicherheitswerkbank sollte z. B. unter der Anleitung eines Apothekers oder Sicherheitsingenieurs geübt werden. Die Sicherheitswerkbank sollte möglichst ununterbrochen betrieben werden (wenn nicht gearbeitet wird, im energiesparenden Stand-by-Verfahren). Im Falle des Nichtbetriebs ist die Arbeitsöffnung mit der Schutzklappe zu verschließen. Abgeschaltete Geräte müssen mindestens 30 Minuten vor Arbeitsbeginn eingeschaltet werden. Nach Arbeitsende sollte stets die Reinigung der Arbeitsfläche (wässrige Reinigungslösung) und vor Arbeitsbeginn eine Wischdesinfektion erfolgen (z. B. mit 70–80 % Isopropanol oder Ethanol (teurer); nicht sprühen wegen Explosionsgefahr!). Alternativ ist auch eine desinfizierende Reinigung nach Arbeitsende möglich. Die Reinigung der Zytostatikaarbeitsplätze in den Sicherheitswerkbänken erfolgt durch das zubereitende Personal selbst. In regelmäßigen Abständen sollten auch alle zugänglichen Bereiche der Zytostatikawerkbank einer Grundreinigung unterzogen und damit eventuell vorhandene Zytostatikakontaminationen inaktiviert bzw. aufgewischt werden.
Einrichtungen, wie z.B. Isolatoren oder vollautomatische geschlossene Systeme (sogenannte Zytostatikaroboter), die eine gleichwertige Sicherheit nach DIN 12980 bieten, dürfen ebenfalls eingesetzt werden. Diese Einrichtungen müssen auf Gleichwertigkeit geprüft und der sichere Betrieb muss analog gewährleistet werden. Studien zeigen, dass vollautomatische Systeme einen mindestens gleichwertigen Mitarbeiterschutz gewähren.
2.1.3 Persönliche Schutzausrüstung
Merke: Im Umgang mit Zytostatika ist eine geeignete (mit CE-Kennzeichen) Schutzausrüstung zu tragen, die vom Arbeitgeber zur Verfügung zu stellen ist: flüssigkeitsdichte Einweghandschuhe, Schutzkittel/-overall, Schutzbrille, Atemschutz, Überschuhe.
Flüssigkeitsdichte Einweghandschuhe: Geeignet sind z. B. ungepuderte, proteinarme Latexhandschuhe der Mindestdicke 0,2 mm, mit guter Griffigkeit, hoher Festigkeit und dokumentierter Qualität (EN ISO 374-Schutzhandschuhe gegen gefährliche Chemikalien; DIN EN 16523-1 Bestimmung des Widerstands von Materialien gegen die Permeation von Chemikalien). Untersuchungshandschuhe aus Latex sind ungeeignet. Die Länge des Handschuhschaftes muss ausreichend sein, um auch während des Arbeitens über dem Bündchen des Schutzkittels dicht abzuschließen. Die Handschuhe sind regelmäßig in einem Zeitabstand von maximal 30 Minuten zu wechseln (Wecker stellen). Bei sichtbarer Kontamination oder Undichtigkeit und nach der Verarbeitung von Carmustin und Thiotepa müssen die Handschuhe sofort gewechselt werden. Zur weiteren Risikominimierung können Handschuhe mit doppelter Wandstärke im Fingerbereich oder zwei Paar Handschuhe übereinander getragen werden. Beim Tragen von zwei Paar Handschuhen können Materialmixe, wie Nitrilhandschuhe auf der Haut (geringere Allergisierungsgefahr) und Latexhandschuhe (nachgewiesene geringe Permeabilität von Zytostatika), sinnvoll sein. Es empfiehlt sich, wegen möglicher Außenkontaminationen beim Auspacken von CMR-haltigen Fertigarzneimitteln Schutzhandschuhe (unsteril ausreichend) zu tragen. Grundsätzlich sollte alles, was mit Zytostatika in Berührung gekommen ist, wie die Infusionsbehältnisse, Spritzen, Infusionssysteme usw., nur mit Handschuhen angegriffen werden, da eine Kontamination mit Zytostatika nie völlig ausgeschlossen werden kann. Mit den behandschuhten Händen sollte möglichst nichts angegriffen werden, was nicht mit dem Prozess zusammenhängt (z. B. Telefon, Schubladengriffe, Türklinken). Andere fassen diese Gegenstände möglicherweise ohne Handschuhe an! Die Handschuhe sollen immer nach außen gekrempelt ausgezogen werden. Nach dem Arbeiten sind die Hände auf jeden Fall zuerst unter fließendem, kaltem Wasser zu waschen. Eine primäre Händedesinfektion mit alkoholischem Händedesinfektionsmittel könnte die Resorption von Zytostatika beschleunigen.
Schutzkittel/Schutzoveralls: Die Schutzkittel/-overalls sollen vorne hochgeschlossen sein und über lange Ärmel und enganliegende Armbündchen verfügen. Beim Zubereiten von Zytostatika an der Sicherheitswerkbank können flüssigkeitsdichte oder textile Einwegkittel/-overalls und darüber gezogene flüssigkeitsdichte Armstulpen empfohlen werden. Die Schutzkittel/-overalls dürfen nicht außerhalb der gekennzeichneten Räumlichkeiten getragen werden und sind mindestens täglich, bei Verunreinigung oder Beschädigung sofort zu wechseln.
Schutzbrille mit Seitenschutz: Eine Korbbrille ist bei der Beseitigung von Zytostatikaverschüttungen zu tragen sowie bei Reinigungsarbeiten der Sicherheitswerkbank.
Atemschutz: Partikelfiltrierende Halbmasken der Schutzstufe P3 (FFP 3) nach DIN EN 149 sind erforderlich beim Aufnehmen von größeren Verschüttungen und sonstigen Fällen, in denen Zytostatika außerhalb der Werkbank gehandhabt werden müssen sowie bei Reinigungsarbeiten der Sicherheitswerkbank. OP-Masken stellen keinen Atemschutz dar, da Aerosole diese ungehindert passieren können.
Überschuhe: Diese sind zu tragen bei der Beseitigung von unbeabsichtigten Verunreinigungen. Das Tragen von geschlossenen Schuhen beim Umgang mit Zytostatika stellt einen Schutz vor herunterfallenden Gegenständen und möglichen Kontaminationen dar.
Technische Hilfsmittel: Es sind grundsätzlich Spritzen und Kanülen mit verriegelbarem Luer-Lock-Anschluss zu benutzen. Beim Arbeiten mit Durchstechflaschen sollen Druckentlastungseinrichtungen (Spikes) mit wasserabweisenden Filtern (aber ohne Partikelfilter im Flüssigkeitsgang) zum automatischen Druckausgleich eingesetzt werden. Dies gilt auch für die Zubereitung an der Sicherheitswerkbank. Zytostatikum und Lösungsmittel bzw. Trägerlösung sollen mit Überleitsystemen (Transfernadeln, Transferkappen) unter internem Druckausgleich zwischen den Behältern überführt werden, sodass bei der abschließenden Diskonnektion keine Druckdifferenzen herrschen, die zur Freisetzung von Zytostatikaaerosolen führen könnten. Es werden verschiedene Überleitsysteme angeboten, die der Gefahr einer relevanten Freisetzung von Zytostatika vorbeugen sollen (z. B. Cyto-set®-Mix, Phaseal®, Tevadaptor®).
Textile Materialien: Die Herstellung von Zytostatikazubereitungen muss zur einfachen Entfernung möglicher Kontaminationen auf einer saugfähigen Unterlage mit flüssigkeitsdichter Unterseite erfolgen. Beim Herausziehen von Kanülen aus Durchstechstopfen und dem Entlüften von Spritzen sind durch Verwendung von Kompressen oder Tupfern Kontaminationen mit Spritzern oder Aerosolen zu vermeiden. Luft und kleinste Mengen überschüssiger Zytostatikalösung sollen unter Verwendung eines sterilen Tupfers vorsichtig und langsam aus der aufgezogenen Spritze herausgedrückt werden.
2.1.4 Unbeabsichtigte Freisetzung von Zytostatika (Spillkit)
Verschüttungen von Zytostatika sind unverzüglich und sachgerecht zu beseitigen. Alle zur Beseitigung erforderlichen Hilfsmittel (Einmaltücher in ausreichender Menge, Handschaufel für Glasbruch, Abfallbehältnis), inklusive einer Anweisung, sind in einem Set (Dekontaminationsset, Spill-Kit) bereitzuhalten. Vor der Beseitigung der Verschüttung ist die komplette Schutzkleidung anzulegen (flüssigkeitsdichter Schutzkittel/-overall, Überschuhe über geschlossenen Schuhen, Handschuhe, Schutzbrille, P3-Atemschutzmaske). Bei größeren Verunreinigungen und Glasbruch sind zusätzliche Schutzhandschuhe (am besten Haushaltshandschuhe) überzuziehen. Die Aufnahme nasser Verschüttungen erfolgt mit trockenen Einmaltüchern (z. B. Zellstoff). Pulvrige Substanzen sind mit angefeuchteten Einmaltüchern aufzunehmen, sie dürfen auf keinen Fall gekehrt werden. Die Beseitigung der Verschüttungen erfolgt vom Rand nach innen. Alle kontaminierten Materialien sind in einem verschließbaren Einwegbehältnis (Abfalltüten) der Entsorgung zuzuführen. Nach Aufnahme der Verschüttungen sind die betroffenen Flächen mit Reinigungslösung und, wenn möglich, ethanolischer Natronlauge (= z. B. 0,1N Natronlauge in 70 %-igem Ethanol) als Inaktivierungslösung zu reinigen.
Kontaminationen
Wenn Patientenwäsche im Rahmen der Zytostatikaapplikation kontaminiert wird, ist diese sofort zu wechseln. Dabei sind Schutzkittel/-overall und Handschuhe zu tragen. Die Wäsche ist wie infektiöse Wäsche zu sammeln und zu behandeln. Dies gilt auch für kontaminierte Mehrwegwäsche von Beschäftigten.
Mit Zytostatika kontaminierte Haut ist sofort unter reichlich fließendem, kaltem Wasser für mindestens 5 bis 10 Minuten zu spülen. Bei Kontamination der Augen sind diese mindestens 10 Minuten mit fließendem Wasser oder NaCl 0,9 % zu spülen. Bei reizenden Stoffen ist umgehend ein Augenarzt aufzusuchen und die verfügbare Stoffinformation (z. B. Sicherheitsdatenblatt) mitzunehmen. Die Maßnahmen müssen Bestandteil der Betriebsanweisung sein und in der Unterweisung vermittelt werden. Nach massiver Kontamination sollte in Absprache mit dem Betriebsarzt erwogen werden, ob der betroffenen Person neben einer Vorsorgeuntersuchung ein Belastungsmonitoring angeboten wird.
2.2 Verpackung, Transport und Entsorgung
Der Transport von CMR-Arzneimittelzubereitungen muss in bruchsicheren, auslaufdichten und verschließbaren Behältnissen erfolgen. Die Transportbehältnisse sind entsprechend zu kennzeichnen, z. B. „Vorsicht Zytostatika“. Die Zubereitungen sollen einzeln in Einschweißbeutel verpackt sein. Es wird empfohlen, das Transportbehältnis mit ausreichend saugfähigem Material auszukleiden. Bei dem Transport handelt es sich wegen der geringen Mengen nicht um einen Gefahrguttransport. Der Transport darf nur durch unterwiesenes Personal erfolgen. Persönliche Schutzausrüstungen sind für den Transport nicht erforderlich.
CMR-Stoff-haltiger Abfall muss so entsorgt werden, dass Dritte nicht gefährdet werden und die abfallrechtlichen Bestimmungen im jeweiligen Bundesland eingehalten werden:
Vollzugshilfe zur Entsorgung von Abfällen aus Einrichtungen des Gesundheitsdienstes der Bund-/Länderarbeitsgemeinschaft Abfall (LAGA), https://www.laga-online.de/documents/m_2_3_1517834373.pdf (aufgerufen am 24.2.2021).
Die Abfälle werden mit einer europaweit einheitlichen Abfallschlüsselnummer (AS) versehen:
18: Abfälle aus der humanmedizinischen oder tierärztlichen Versorgung und Forschung, z. B. 18 01 08: Zytotoxische und zytostatische Arzneimittel.
Hinweise für die Kennzeichnung von Abfallsammel- und Abfalltransportbehältern gibt die TRGS 201 „Einstufung und Kennzeichnung bei Tätigkeiten mit Gefahrstoffen“; zur Entsorgung insgesamt die BGW-Publikation „Abfallentsorgung – Information zur sicheren Entsorgung von Abfällen im Gesundheitsdienst“.
Zytostatikareste und mit Zytostatika verunreinigte Materialien können sowohl bei der Zubereitung als auch bei der Verabreichung anfallen, so beispielsweise Reste konzentrierter und verdünnter Zytostatikalösungen (z. B. in Infusionsbehältnissen, Zuleitungen, Infusionssystemen), leere Infusionsbehältnisse und Spritzen, Hilfsmittel wie Kanülen, Tupfer, Handschuhe.
CMR-haltige Abfälle (AS 18 01 08), die hauptsächlich aus festen Zytostatikaresten bestehen (z. B. Trockensubstanzen, Filter aus Sicherheitswerkbänken), werden mit der UN 2811 und Lösungen in einer Menge von über 20 ml in Applikationszubehör, mit großen Mengen Flüssigkeit kontaminierte Materialien werden mit der UN 2810 gekennzeichnet und entsorgt. Der besonders überwachungsbedürftige Abfall ist in bauartgeprüften, dicht schließenden und ausreichend widerstandsfähigen Abfalltonnen zu sammeln und der Entsorgung zuzuführen. Das Transportbehältnis soll ausreichend Bindemittel enthalten, damit eventuell freiwerdende Flüssigkeit aufgesaugt wird. Um beim Öffnen des Deckels der Sonderabfalltonnen die Freisetzung von Zytostatika zu vermeiden, empfiehlt es sich, die Materialien in Plastikabfalltüten zu verpacken und diese z. B. durch Verknoten zu verschließen. Auf den Abfalltonnen muss das Totenkopfsymbol angebracht werden (Gefahrzettel Nr. 6.1.).
Geringfügig mit CMR-Arzneimitteln kontaminierte Materialien (Tupfer, Spritzen, leere Behältnisse, Einwegschutzkleidung etc.) können zusammen mit Abfällen nach dem AS 18 01 04 (Patientenpflegemüll ohne besondere Anforderungen aus infektionspräventiver Sicht, früher B-Abfälle) entsorgt werden. Scharfe oder spitze Gegenstände, wie Kanülen, Überleitkanülen, Spikes etc. (AS 18 01 01), müssen in durchstoßfesten und sicher verschließbaren Behältern (z. B. Kanülenabwurfbehältern) am Entstehungsort gesammelt werden.
Körperflüssigkeiten und Ausscheidungen von mit CMR-Arzneimitteln behandelten Patienten können in die Kanalisation eingeleitet werden. Beim Umgang mit Ausscheidungen müssen die allgemeinen hygienischen Richtlinien eingehalten und zumindest Schutzhandschuhe getragen werden. Das Sammeln von 24-Stunden-Urin soll während der Behandlung mit CMR-Arzneimitteln vermieden werden.
Mehrwegwäsche ist ohne weitere Behandlung zu sammeln und in der Wäscherei aufzubereiten. Zytostatika werden in geringen Mengen auch mit dem Schweiß ausgeschieden, was bei der Bettenaufbereitung zu beachten ist. Die Matratzen sind mit einer Matratzenhülle zu versehen. Für Bereiche, in denen mit Zytostatika umgegangen wird, ist das Reinigungspersonal hinsichtlich des Gefährdungspotenzials, Schutzmaßnahmen und Entsorgung der Reinigungslösungen und Abfallentsorgung zu schulen. Bei allen Reinigungsmaßnahmen sind Schutzhandschuhe zu tragen. Es genügt die Verwendung von üblichen Reinigern in den Reinigungslösungen, doch sollten die Arbeitsmittel (Putzwagen, Putzeimer usw.) für den möglicherweise kontaminierten Bereich reserviert sein und nicht in anderen Bereichen eingesetzt werden. Die Wischtücher dürfen nur für einmaliges Wischen verwendet und nicht im Wischwasser ausgewaschen werden. Die Wischtücher können Einmaltücher sein oder in der Wäscherei aufbereitet werden.
2.3 Pharmazeutische Aspekte der Herstellung und Applikation von Zytostatika
Zur Vorbereitung der zytostatikahaltigen Injektionen und Infusionen sind die Herstellerangaben zu beachten. Im Teil Zytostatika Abschnitt Lösungs- und Applikationsvorschriften findet sich eine Auflistung der Antitumorarzneimittel, alphabetisch geordnet nach Wirkstoffnamen und Beispielen von Fertigarzneimitteln, sowie Angaben zur Vorbereitung der applikationsfertigen Lösungen. Es sind die erforderlichen Lösungsmittel nach Art und Menge sowie die geeigneten Infusionsträgerlösungen aufgeführt. Wenn eine Trägerlösung mit Ausrufungszeichen versehen ist, darf nur diese eingesetzt werden. Das Volumen der Infusionslösung kann je nach Therapieschema und Infusionsdauer variieren. Wenn bestimmte Konzentrationen einzuhalten sind, wird darauf hingewiesen.
Als Behältnismaterial für Infusionslösungen soll Glas wegen der Bruchgefahr ausgeschlossen werden. Infusionsträgerlösungen in PVC(Polyvinylchlorid)-Beuteln werden wegen der enthaltenen Weichmacher als problematisch erachtet. Eingesetzt werden sollen Infusionsträgerlösungen in Infusionsbeuteln bzw. Plastikflaschen bestehend aus Polyethylen (PE) (z. B. Ecobag® von B. Braun, Freeflex® von Fresenius Medical) bzw. Polypropylen (PP) (z. B. Ecoflac® von B. Braun).
Die Polyethylen-Beutel sind für die Zytostatikaapplikation besonders geeignet. Sie sind inert, flexibel, sehr gut durchsichtig und kollabieren gleichmäßig. Im Teil Zytostatika Abschnitt Lösungs- und Applikationsvorschriften finden sich Angaben zur Verträglichkeit für die einzelnen Zytostatika mit den diversen Kunststoffen. Wenn die Verträglichkeit nicht durch experimentelle Untersuchungen gesichert ist, sondern auf Plausibilitätsüberlegungen basiert, ist der betreffende Kunststoff eingeklammert. Die Materialeigenschaften können auch für das Infusionszubehör geeignet sein. So dürfen Paclitaxel-Infusionen nicht mit DEHP(=Weichmacher)-haltigem PVC-Infusionszubehör (Infusionsfilter, Infusionsgerät) appliziert werden, sondern ausschließlich mit den dafür empfohlenen PVC-freien oder PVC-armen Systemen.
Die im Teil Zytostatika Abschnitt Lösungs- und Applikationsvorschriften angegebenen Aufbewahrungsbedingungen für die applikationsfertigen Zubereitungen gelten für zentral in der Apotheke hergestellte Zubereitungen, die auch ein definiertes Haltbarkeitsdatum haben. Nicht unter Reinraumbedingungen vorbereitete Injektionen und Infusionen sind unmittelbar nach der Zubereitung (spätestens nach 1 Stunde Aufbewahrung) anzuwenden (d. h. Applikation beginnen). Alle Anbrüche sind zu verwerfen!
In der Spalte Besonderheiten wird beispielsweise darauf hingewiesen, dass die Zubereitungen von Dacarbazin und Fotemustin auch während der Applikation strengstens vor Licht zu schützen sind: Infusionsbehältnis und Infusionssystem bedürfen des Lichtschutzes. Bei Carmustin, Cisplatin, Temsirolimus und Gemtuzumab-Ozogamicin genügt Lichtschutz für das Infusionsbehältnis. Unter Lichteinfluss kommt es zur raschen Zersetzung dieser Wirkstoffe, woraus eine erhöhte Toxizität oder reduzierte Wirksamkeit resultiert. Alle anderen Zytostatika können ohne Lichtschutz der Infusionslösung appliziert werden. Der maximal mehrere Stunden andauernde Lichteinfluss hat keine relevanten, nachteiligen Wirkungen auf die Infusionslösungen. In der Spalte Besonderheiten finden sich auch Hinweise auf die Notwendigkeit oder Schädlichkeit der Verwendung eines Infusionsfilters (Inline-Filter). Eine Grobfilterung der Infusionslösung über einen 15-µm-Filter findet in der Tropfkammer der Infusionsgeräte statt. Eine weitere Partikelfiltration kann über Infusionsfilter der Porengröße 5 µm oder auch bakteriendichte Filter der Porengröße 0,2 µm erfolgen, was z. B. für Paclitaxel-Infusionen empfohlen wird. Andererseits können liposomale Infusionslösungen derartige Filter nicht passieren und einige Zytostatika (z. B. Asparaginase, Dactinomycin) werden von den Filtermaterialien absorbiert, sodass bei deren Applikation die Filter nicht zum Einsatz kommen dürfen.
2.4 Kompatibilität/Inkompatibilität beim Zubereiten und Anwenden
Im Rahmen der Antitumortherapie werden in der Regel mehrere Zytostatika/Immuntherapeutika sowie Supportivtherapeutika verabreicht, sodass häufig Parallelinfusionen erforderlich sind. Die Infusionsmischung verschiedener Zytostatikalösungen oder von Zytostatikalösungen mit Trägerlösungen, Hydratationslösungen oder sonstigen Arzneimitteln aber kann wegen der Unverträglichkeit der Lösungen (Inkompatibilität) zur Inaktivierung der Kombinationspartner, z. B. durch Auskristallisation, oder der Bildung toxischer Reaktionsprodukte führen. Die Gefahr der Inkompatibilität ist umso größer, je höher konzentriert die Lösungen und je länger die Kontaktzeiten sind. Die Mischung inkompatibler Infusionslösungen – auch in den Infusionsleitungen bei Parallelinfusion – muss möglichst vermieden werden. Experimentell bestätigte Inkompatibilitäten (Unverträglichkeiten) und experimentell bestätigte Kompatibilitäten (Verträglichkeiten) sind für das jeweilige Zytostatikum im Teil Zytostatika Abschnitt Lösungs- und Applikationsvorschriften angegeben. Inkompatible Kombinationspartner sollen weder parallel infundiert werden, noch dürfen damit Mischinfusionen hergestellt werden.
Auch wenn mit bloßem Auge keine Veränderungen sichtbar sind, kann man nie sicher sein, dass die Mischung nicht zu einer chemischen Reaktion führt, die für den Patienten von Nachteil ist.
Finden sich in der Tabelle im Teil Zytostatika Abschnitt Lösungs- und Applikationsvorschriften keine Angaben zu Kompatibilität, ist immer von Inkompatibilität auszugehen und auf jeden Fall eine getrennte Applikation vorzunehmen. Bei speziellen Fragen zur Verträglichkeit von Infusions- und Injektionslösungen wenden Sie sich an Ihre Apotheke.
Als Hydratationslösung werden immer häufiger Vollelektrolytlösungen wie Jonosteril® und Sterofundin®Iso anstelle von Natriumchlorid 0,9 % und Glucose 5 % Infusionslösung angewendet, um eine Chlorid-Acidose zu vermeiden. Bei der Parallelinfusion und dem Einsatz als Spüllösung bei der Zytostatikaapplikation muss auf die Unverträglichkeit der enthaltenen Ionen mit Zytostatika geachtet werden. So dürfen Carfilzomib, Oxaliplatin, Bleomycin und Pemetrexed nicht mit den Vollelektrolytlösungen über gemeinsame Leitungen infundiert werden. Amsacrin fällt als Amsacrinhydrochlorid mit allen chloridhaltigen Lösungen aus und es darf nur Glucose 5 % Infusionslösung als Trägerlösung und als Spüllösung für das Infusionssystem eingesetzt werden.
Inkompatibilitäten treten häufig infolge von pH-Wert-Verschiebungen auf, so z. B. bei Kontakt von sauren Lösungen mit alkalischen Lösungen, wie natriumhydrogenkarbonat-haltigen Lösungen. Natriumhydrogencarbonatlösung wird in erster Linie zur Alkalisierung des Urins und verbesserten Ausscheidung bei Methotrexat-(Hochdosis-)therapien eingesetzt. Methotrexat-Infusionslösungen selbst sind mit Natriumhydrogencarbonatlösung kompatibel. Im Teil Zytostatika Abschnitt Lösungs- und Applikationsvorschriften sind Zytostatika aufgelistet, die mit Natriumhydrogenkarbonat(= Natriumbikarbonat, kurz Bikarbonat)-Lösungen inkompatibel sind. Diese Zytostatika sollen nicht mit bikarbonathaltigen Infusionen zeitgleich über das gleiche Lumen eines zentralvenösen Katheters infundiert werden. Zu beachten ist auch die Unverträglichkeit von bikarbonathaltigen Lösungen mit Vollelektrolytlösungen. Mit den enthaltenen Calciumionen kann es zu Auskristallisation von Calciumcarbonat kommen.
| Folgende Zytostatika sollten nicht parallel mit Natriumbikarbonat-Lösungen infundiert werden: | |
| 5-Fluorouracil | Fotemustin |
| Alemtuzumab | Gemtuzumab Ozogamicin |
| Amsacrin | Idarubicin |
| Asparaginase | Interleukin |
| Bendamustin | Irinotecan |
| Calciumfolinat | Mitoxantron |
| Carboplatin | Oxaliplatin |
| Cetuximab | Pemetrexed |
| Carmustin | Rituximab |
| Cisplatin | Topotecan |
| Cladribin | Trastuzumab |
| Dacarbazin | Vinblastin |
| Daunorubicin | Vincristin |
| Doxorubicin | Vindesin |
| Epirubicin | Vinorelbin |
| Filgrastim | |
| Zur Sicherheit in der praktischen Anwendung sollten immer die Informationen der Hersteller berücksichtigt werden. | |
2.5 Verabreichung von Zytostatika
Unter Verabreichen von CMR-Arzneimitteln werden in der TRGS 525 alle Tätigkeiten zur Anwendung des zubereiteten Arzneimittels am Patienten verstanden. Dazu gehört das Anstechen der applikationsfertigen Infusion, das Anbringen des Infusionsgerätes (Konnektieren) am Patienten sowie die Abnahme und Beseitigung des Infusionszubehörs. Vor jeder Zytostatikaapplikation müssen Patient und Zytostatikalösung eindeutig identifiziert werden. Dazu eignen sich insbesondere die Barcode-Identifizierung des Patienten und der patientenindividuellen Zubereitung. Die Dosierung der Zytostatikalösung ist anhand der Deklaration auf dem Injektions-/Infusionsbehältnis zu prüfen. Zudem ist zu prüfen, ob die notwendige Prämedikation, z. B. Antiemetika oder Antihistaminika, appliziert wurde und der erforderliche Zeitabstand eingehalten ist.
Bei allen Handhabungen sind zumindest Handschuhe zu tragen. Alle Verbindungen sollen über einen verriegelbaren Anschluss hergestellt werden, um auch unter Zug oder Druck sicher und fest zu sitzen.
Bevorzugt werden spezielle Sicherheitssysteme für die Zytostatikaapplikation (z. B. Cyto-Set, Codan Connect Z) verwendet. Wird mit herkömmlichen Systemen gearbeitet, so ist das Infusionssystem zunächst mit Trägerlösung (passend zum Zytostatikum, siehe Abschnitt Kompatibilität/Inkompatibilität) zu befüllen und zu entlüften.
Wenn die speziellen Mehrfachinfusionssysteme eingesetzt werden, wird die zytostatikahaltige Infusionslösung mit nadelfreien Adaptern mit einer Leitung des Mehrfachinfusionssystems verbunden. Integrierte Rückschlagventile verhindern ein Zurückfließen von Zytostatika in die angeschlossenen Sekundärleitungen. Die Sekundärleitungen mit diesen Adaptern werden häufig bereits bei der zentralen Zubereitung des Zytostatikums angeschlossen.
Wenn konventionelle Infusionssysteme benutzt werden, wird am mit Trägerlösung vorbefüllten Infusionssystem die Verschlusskappe am Kanülen-/Katheteranschluss wieder aufgesetzt, der Tropfenregler ganz zugedreht und die Zytostatikainfusion verbunden. Hierbei ist der Einstichdorn so durch den Verschluss des Infusionsbehältnisses zu stecken, dass möglicherweise heraustropfende Zytostatikalösung nicht die Handschuhe benetzt. Das Infusionsgerät ist also immer in stehende oder liegende Infusionsbehältnisse, nie in hängende Infusionsbehältnisse, zu stecken.
Injektion von Zytostatika
Die Injektion von Zytostatikalösungen sollte am besten im Bypass über eine laufende Infusion und über eine Venenverweilkanüle oder eine Butterfly-Kanüle erfolgen. Auf das Entlüften von Spritzen und gegebenenfalls auch Kanülen nach Konnektion ist zu verzichten. Die minimale Menge von Luft in der Kanüle schadet dem Patienten bei Injektion nicht, doch würde beim Entlüften eine zusätzliche Gefahr der Kontamination bestehen. Vor jeder Zytostatikaapplikation ist eine Kontrollaspiration vorzunehmen und es sind jeweils 5–10 ml Trägerlösung vor- und nachzuspülen. Während der Zytostatikaapplikation soll der Arm des Patienten bequem auf einer saugfähigen Unterlage gelagert werden. Dem Patienten ist das Ruhighalten der Extremität zu empfehlen, ebenso wie sofortiges Alarmieren bei Schmerzen, Schwellung, Rötung oder sonstigen Symptomen.
Bei periphervenöser Applikation ist das Risiko der Paravasation höher als bei zentralvenöser Injektion. Nekrotisierende Zytostatika können bei Paravasation zu Ulzerationen und zur Gewebezerstörung führen. Insbesondere Anthrazykline, wie z. B. Doxorubicin, Epirubicin und Idarubicin, sowie Vinca-Alkaloide, wie Vinblastin, Vincristin, Vindesin und Vinorelbin, sowie Mitomycin und Dactinomycin sind daher periphervenös nur mit größter Vorsicht und strenger Überwachung zu applizieren.
Begünstigende Faktoren für Paravasation stellen „schlechte“ Venen (z. B. dünn, brüchig, entzündet, sklerosiert), wiederholte Punktionsversuche (z. B. erneute Punktion distal zu einer misslungenen Punktion), verminderter venöser Blutstrom bei Herzerkrankungen oder Lymphstau, eine lange Infusionsdauer und ungenügendes Fixieren des periphervenösen Zugangs dar.
Größere Venen sind immer gegenüber kleineren zu bevorzugen. Für die Applikation von nekrotisierenden Zytostatika sind Venen des Unterarms gegenüber Venen des Handrückens und des Handgelenks zu bevorzugen. Bei Letzteren fehlt der Schutz von umgebendem Muskelgewebe für die wichtigen Nerven und Sehnen.
Die periphervenöse Dauerinfusion mittels Pumpe ist auf jeden Fall bei nekrotisierenden Zytostatika zugunsten der zentralvenösen Applikation zu vermeiden! Die notfallmäßige Behandlung von Paravasaten wird im Abschnitt Verhalten bei Paravasaten erläutert.
Während der gesamten Applikation ist auf Undichtigkeiten zu achten, die zu einer Kontamination der Umgebung mit Zytostatika führen könnten. Für den Fall unbeabsichtigter Freisetzung von Zytostatikalösungen ist auch in den Infusionsräumlichkeiten ein Dekontaminationsset/Spill-Kit bereitzuhalten.
Bei der Verwendung von Zytostatikasicherheitssystemen wird das System nach jeder Infusion, wie auch am Ende gespült, sodass keine bzw. minimale Wirkstoffmengen zurückbleiben und die Kontaminationsgefahr als gering zu sehen ist.
Bei herkömmlichen Systemen sind nach Ende der Infusion die Infusionssysteme (Spritzen, Infusionsleitungen, Infusionsgeräte) so vom Zugang zu trennen, dass etwaige Zytostatikareste im System verbleiben und nicht die Umgebung benetzen. Bei der üblichen Applikation von Infusionen über Infusionsgeräte können dort 10–20 ml verbleiben, was bei einer 100-ml-Infusion 10–20 % Verlust bedeutet. Bei einem Infusionsvolumen bis 100 ml muss daher gewährleistet sein, dass das Infusionsgerät leerläuft oder mit 10–20 ml reiner Trägerlösung nachgespült wird (siehe Abschnitt Applikation). Mit zunehmendem Infusionsvolumen nimmt der prozentuale Verlust ab. Die leeren Infusionsbehältnisse und Infusionssysteme sowie Spritzen und Kanülen sollen nicht voneinander getrennt, sondern komplett entsorgt werden. Kanülen dürfen nicht mit Schutzkappen versehen werden (kein recapping). Infusionsständer und Infusionspumpen sollten nach jeder Verabreichung gereinigt werden; dabei sind Schutzhandschuhe zu tragen.
Bei speziellen Applikationsformen, z. B. Blaseninstillation, Peritonealinstillation, transarterielle Chemoembolisation und hypertherme intraperitoneale Chemoperfusion (HIPEC), sind entsprechend der Kontaminationsgefahr Schutzhandschuhe, wasserdichte Schutzkittel, Schutzbrille und Atemschutz zu tragen. Beim PIPAC-Verfahren werden Zytostatika-Aerosole minimal-invasiv über eine Pumpe in den Bauchraum eingebracht. Auch wenn in Studien bisher keine Kontamination der Raumluft nachgewiesen wurde, ist prinzipiell durch Undichtigkeiten eine Kontamination der Umgebung und des Personals möglich. Das OP-Personal befindet sich während des Einbringens des Zytostatika-Aerosols und der 30-minütigen Verweilzeit des Aerosols aus Gründen der Sicherheit außerhalb des OP-Raumes, von wo aus die Pumpe ferngesteuert und der Patient überwacht wird. Der OP-Bereich wird nur im Notfall (z. B. Patient wird kreislaufinstabil) mit entsprechender Schutzausrüstung betreten.
Orale Verabreichung und Salben
Im Umgang mit zytostatikahaltigen Tabletten und anderen Arzneiformen zur oralen Verabreichung sind Schutzhandschuhe zu tragen. Das Teilen solcher Tabletten sollte möglichst umgangen werden, da es dabei zwangsläufig zur Freisetzung von zytostatikahaltigen Stäuben kommt. Unter Arbeitsschutzaspekten erscheint es angebracht, Dosierungen oder Dosierungsintervalle so zu gestalten, dass ganze Tabletten verabreicht werden können. Wenn immer möglich, sollen bei abweichenden Dosierungen und insbesondere bei pädiatrischen Patienten die Arzneistoffe in Form einer oralen Suspension oder Lösung verabreicht werden, um die Freisetzung von Stäuben zu umgehen. Einige Arzneistoffe (z. B. Hydroxycarbamid, Mercaptopurin, Methotrexat, Thioguanin) stehen als zugelassene (Import-)Fertigarzneimittel zur Verfügung. Für andere Arzneistoffe (z. B. Cyclophosphamid, Etoposid, Irinotecan) kann in der Apotheke die i.v. Lösung in der passenden Dosierung in Oralspritzen aufgezogen werden. Auch für die Gabe über die Ernährungssonde sind die Suspensionen oder Lösungen geeignet. Die Tabletten dürfen auf keinen Fall gemörsert werden. Das Herstellen einer Suspension für die Sondenapplikation aus einer ganzen Tablette oder Kapsel kann mit einer 20-ml-Luer-Lock-Spritze erfolgen. Dabei ist Schutzkleidung zu tragen (Handschuhe, FFP3-Maske, Schutzkittel). Die Tablette wird nach Herausziehen des Kolbens in die Spritze gelegt. Der Kolben wird wieder aufgesetzt, es wird etwa 10 ml steriles Wasser aufgezogen, die Spritze verschlossen und leicht hin und her geschwenkt. Nach der Applikation wird erneut Wasser aufgezogen, um verbliebene Tablettenreste zu applizieren.
Ist das Brechen von Tabletten nicht zu vermeiden, kann dies zum Schutz vor Kontamination in Druckverschlussbeuteln erfolgen. Beim Teilen muss Schutzkleidung getragen werden (Handschuhe, FFP3 Maske, Schutzkittel). Die Tablette wird im geschlossenen Druckverschlussbeutel ggf. mit einem Tablettenteiler geteilt. Nach dem Teilen ist ein Moment zu warten und dann die Tablettenhälfte zu entnehmen. Falls die Tabletten in Dispensern verteilt werden, sind dafür gesonderte Dispenser zu verwenden, die so zu reinigen sind, dass ein Kontakt mit der Reinigungslösung der übrigen Dispenser vermieden wird. Alternativ können Einnahmebecher für die Einmalanwendung benutzt werden.
Das Auftragen von zytostatikahaltigen Salben (z. B. fluorouracil-haltig) muss mit Schutzhandschuhen unter Verwendung eines Spatels erfolgen.
2.6 Arbeitsschutzrechtliche Bestimmungen
2.6.1 Betriebsanweisung und mündliche Unterweisung
Für den Umgang mit CMR-Arzneimitteln müssen Betriebsanweisungen erstellt werden. Sie sind Teil der Unterrichtung, die arbeitsplatzbezogen vor Aufnahme der Tätigkeit und mindestens jährlich durch die betrieblichen Vorgesetzten mündlich zu erfolgen hat und die auftretenden Gefahren und Schutzmaßnahmen zum Inhalt hat. Bei maßgeblichen Veränderungen ist die Betriebsanweisung zu aktualisieren und das Personal zu unterweisen. Die mündliche Unterweisung sollte durch praktische Übungen ergänzt werden. Die Teilnahme an der Unterweisung muss durch Unterschrift bestätigt werden.
Gefahrstoffverordnung § 14 Unterrichtung und Unterweisung der Beschäftigten
Mindestens folgende Angaben:
- Bezeichnung der am Arbeitsplatz auftretenden Gefahrstoffe, Kennzeichnung, Gefährdungen
- Informationen über angemessene Vorsichtsmaßregeln am Arbeitsplatz (Verhütung der Exposition, Schutzausrüstung, Schutzkleidung, Hygienevorschriften)
- Informationen über Maßnahmen bei Betriebsstörungen, Unfällen
Beispielhafte Betriebsanweisungen: siehe BGW-Themenheft „Zytostatika im Gesundheitsdienst“ [1]
Mutterschutz-, Jugendarbeitsschutzgesetz: Schwangere, Stillende und Jugendliche dürfen nicht mit Zytostatika umgehen.
Gefahrstoffverordnung (GefStoffV), basierend auf dem Chemikaliengesetz: unter anderem Vorgaben für Gefahrstoffverzeichnis, Gefährdungsbeurteilung, Anzeigepflicht für den Umgang mit CMR-Arzneimitteln gegenüber Gewerbeaufsicht, Schutzstufen, Betriebsanweisung, Unterweisung des Personals, arbeitsmedizinische Vorsorge, Verordnung zur arbeitsmedizinischen Vorsorge
2.6.2 Technische Regeln für Gefahrstoffe (TRGS)
(www.baua.de; aufgerufen am 24.2.2021)
TRGS 400: Gefährdungsbeurteilung für Tätigkeiten mit Gefahrstoffen: Ermitteln und Beurteilen der Gefährdungen durch Gefahrstoffe am Arbeitsplatz: Vorgehensweise (Ermittlungspflichten)
TRGS 525: Gefahrstoffe in Einrichtungen der medizinischen Versorgung: Umgang mit Gefahrstoffen wie CMR-Arzneimittel, Schutzmaßnahmen beim Auspacken, Zubereiten und Anwenden, bei Lagerung, Transport, Entsorgung
TRGS 555: Betriebsanweisung und Unterweisung der Beschäftigten
2.6.3 Behördlich und berufsgenossenschaftlich anerkannte Verfahren (BuBaV)
Anforderungen an den Betrieb von Sicherheitswerkbänken mit Luftrückführung für Arbeiten mit krebserzeugenden oder erbgutverändernden Zytostatika, 1998 bzw. Bundesarbeitsblatt 3 (2000) 65, spezifiziert den Betrieb von Sicherheitswerkbänken mit Luftrückführung
Berufsgenossenschaft für Gesundheitsdienst und Wohlfahrtspflege
Literatur
- Berufsgenossenschaft für Gesundheitsdienst und Wohlfahrtspflege: Zytostatika im Gesundheitsdienst, Informationen zur sicheren Handhabung von Zytostatika, 2019, detailliert die Umsetzung der TRGS 525; https://www.bgw-online.de/DE/Medien-Service/Medien-Center/Medientypen/BGW-Broschueren/BGW09-19-042_Zytostatika_im_Gesundheitsdienst.html (aufgerufen am 17.04.2024)
- Berufsgenossenschaft für Gesundheitsdienst und Wohlfahrtspflege: Gefahrstoffrechtliche Kennzeichnung von Arzneistoffen in der Tumortherapie, 2018; https://www.bgw-online.de/DE/Medien-Service/Medien-Center/Medientypen/BGW-Broschueren/BGW09-19-008-Gefahrstoffrechtliche-Kennzeichnung-Arzneistoffe-Tumortherapie.html (aufgerufen am 17.04.2024)
2.7 Die Durchführung der zytostatischen Therapie aus pflegerischer Sicht
Mirko Laux, Sabine Gärtner, Rolf Bäumer, Rita Bodenmüller-Kroll
Die Aufklärung des Patienten über Art, Umfang und eventuelle Nebenwirkungen der zytostatischen Behandlung liegt in der Hand des behandelnden Arztes. Zur Durchführung intravasaler zytostatischer Therapie ist die Beschäftigung qualifizierten Personals sicherzustellen. Neben staatlich geprüftem Pflegepersonal, möglichst mit der Fachweiterbildung „Krankenpfleger/in für die Onkologie“ und/oder „Palliative Care“, können in onkologischen Schwerpunktpraxen zur Assistenz qualifizierte Medizinische Fachangestellte hinzugezogen werden. Da in der Ausbildung zur medizinischen Fachangestellten keine onkologischen Erkrankungen behandelt werden, sollten in einer „Fortbildung für Medizinische Fachangestellte in der Onkologie“ mit 120 Stunden entsprechende Kenntnisse erworben werden. Diese Fortbildungen werden nach einem Curriculum gesteuert, welches von der Bundesärztekammer festgelegt wurde.
Für Personal, das über keine Weiterbildung verfügt, sollte eine spezielle Schulung angeboten werden. Die KOK (Konferenz onkologischer Kranken- und Kinderkrankenpflege) hat hierzu entsprechende Empfehlungen aus haftungsrechtlicher Sicht veröffentlicht und ebenso Inhalte für eine 2-tägige Fortbildungsveranstaltung festgelegt (https://www.kok-krebsgesellschaft.de/service/handlungsempfehlungen/zytostatika/ (aufgerufen am 24.2.2021)).
Vor Beginn der Behandlung muss das Einverständnis des Patienten vorliegen; das gesamte therapeutische Team sollte darüber informiert sein. Die Erstgabe von Zytostatika sollte immer durch den behandelnden Arzt erfolgen. Dasselbe gilt für die Applikation von Zytostatika, bei denen Gewebenekrosen durch Paravasate entstehen können. Deshalb sollten alle Pflegekräfte und Medizinischen Fachangestellten, die in die Verabreichung von zytostatischen Substanzen involviert sind, genauestens die Art der Verabreichung, Wirkung und Nebenwirkungen der Zytostatika kennen. Dazu gehört auch das schriftliche Vorliegen des Behandlungsplans für jeden Patienten, die genaue Dokumentation auftretender Nebenwirkungen und die exakte Patientenbeobachtung während der gesamten Behandlung.
2.7.1 Die Verantwortlichkeit des Pflegepersonals bei der Ausführung ärztlicher Tätigkeiten
Aufgrund der Arbeitsteilung zwischen Arzt und Pflegepersonal muss man die verschiedenen Verantwortungsebenen unterscheiden. Dem Arzt obliegt die Anordnungsverantwortung, dem Pflegepersonal die Durchführungsverantwortung. Die typischen Fälle eigentlich ärztlicher Tätigkeiten, die an Pflegekräfte delegiert werden können, sind Injektionen, Infusionen und Blutentnahmen. Delegationen sind vor dem Hintergrund des Arbeits- und Haftungsrechts zu sehen. Injektionen, Infusionen und Blutentnahmen sind Eingriffe, die zum Verantwortungsbereich des Arztes gehören. Im Vordergrund der pflegerischen Aufgaben stehen die Grund-, Behandlungs- und Funktionspflege. Problematisch ist, dass aus dem Pflegeberufereformgesetz (PflBRefG) von 2017 keine ausdrücklichen Vorgaben für die Delegation ärztlicher Tätigkeiten an Pflegepersonen hervorgehen. Es ist aber in § 5 Abs. 3, Ziff. 2 PflBRefG festgelegt, dass die Ausbildung dazu befähigen soll, „ärztlich angeordnete Maßnahmen eigenständig durchzuführen, insbesondere Maßnahmen der medizinischen Diagnostik, Therapie oder Rehabilitation“. Die Rechtsprechung hat, da es an eindeutiger gesetzlicher Regelung fehlt, Delegationskriterien erarbeitet. Das persönliche und fachliche Vermögen der Pflegekraft ist hierbei das wichtigste Kriterium. Dem delegierenden Arzt bleibt indes die Aufgabe zu prüfen, ob die angewiesene Pflegekraft über das erforderliche Fachwissen und Können verfügt. Ihm obliegt die Anordnungsverantwortung.
Übertragbare Kriterien abgestuft nach Gefahrenbereichen:
- Tätigkeiten mit relativer Einfachheit
- Tätigkeiten mit nur geringer Gefährdungstendenz
- Tätigkeiten mit absoluter Kontrollierbarkeit bei höherer Gefahrneigung
- Tätigkeiten mit absoluter Beherrschbarkeit bei fehlender Arztpräsenz
Zu den nicht delegationsfähigen Tätigkeiten gehört nach dem Transfusionsgesetz die Verabreichung von Blutprodukten. Dies ist ausschließlich ärztliche Tätigkeit; die Aufgaben des Pflegepersonals liegen in der Vorbereitung von Blutprodukten, der Überwachung des Patienten und der exakten Dokumentation nach den Richtlinien des Transfusionsgesetzes.
Literatur
Genge DE (2008) In: Bäumer, Maiwald (Hrsg) Onkologische Pflege, Thieme, Stuttgart
Weiß T, Meißner T & Kempa S (2018) Pflegeberufereformgesetz (PflBRefG), Springer Gabler, Wiesbaden
3 Verhalten bei Paravasaten
Jürgen Barth
Wenn der Zugang zum Gefäßsystem des Patienten disloziert und das betroffene Blutgefäß, üblicherweise eine Vene, durchstochen wurde oder es aus sonstigen Gründen zum Substanzaustritt in das umliegende Gewebe kommt, spricht man von einem Paravasat oder einer Extravasation. Unter den parenteral verabreichbaren Substanzen können von den lokal völlig untoxischen und subkutan oder intramuskulär verabreichbaren die sogenannten Irritanzien und Vesikanzien unterschieden werden (Tabelle unten). Während ein Irritans lokale Schmerzen, Brennen, eine atypische Entzündung des Gefäßes bis zur Phlebitis verursachen kann, bewirkt ein Vesikans eine Nekrose. Hierbei handelt es sich um die schwerste Folge einer lokalen „Stoffwechselstörung“. Sie geht immer mit einem Gewebetod einher (Abbildung unterhalb).
Zu spät erkannt oder zu spät behandelt führt eine Nekrose letztlich zu Gewebeveränderungen mit oder ohne Gewebeschwund (Dystrophie und Atrophie). Grundsätzlich können Nerven, Muskeln und Sehnen geschädigt werden. An Gelenken im Extremitätenbereich kann es zu Funktionsverlust kommen. Die Schädigungen erfordern teilweise die plastisch-chirurgische Intervention. Es finden sich auch Berichte über Extremitätenamputationen [1, 2].
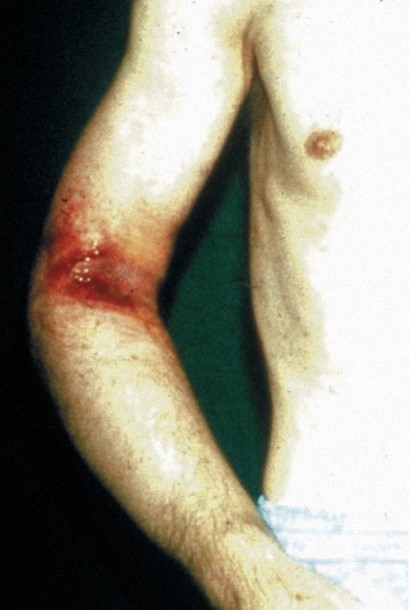
Die Art der lokalen Reaktion hängt von verschiedenen Faktoren ab wie:
pH-Wert (des aufgelösten Fertigarzneimittels → stark sauer ↔ stark alkalisch wie Säuren oder Laugen)
- Osmolarität
- Hypersensitivität gegen die Substanz
- Substanzmenge
- Substanzeigenschaften wie vesikant oder nekrotisierend
- Einwirkdauer
3.1 Einteilung der Zytostatika in Irritanzien bzw. Vesikanzien
| Wirkstoffname | Schädigungstyp | Allgemeine Maßnahmen (s. nachfolgende Tabelle) | Substanzspezifische Maßnahmen |
| Amsacrin | gewebenekrotisierend | III | + DMSO topisch, Kälte CAVE! NICHT bei Einsatz von Dexrazoxan (siehe Hinweise dort) |
| Asparaginase | nicht gewebeschädigend | I | keine |
| Azacitidin | nicht gewebeschädigend | I | keine |
| Belantamab Mafodotin | gewebereizend | I | keine |
| Bendamustin | gewebereizend | II | keine |
| Bevacizumab | nicht gewebeschädigend | I | keine |
| Bleomycin | nicht gewebeschädigend | I | keine |
| Blinatumumab | nicht gewebeschädigend | I | keine |
| Bortezomib | gewebereizend | II | keine |
| Brentuximab Vedotin | gewebereizend | I | keine |
| Busulfan | gewebereizend | II | keine |
| Carboplatin | nicht gewebeschädigend, aber potenziell allergen | I | keine |
| Carmustin | gewebereizend | II | keine |
| Carfilzomib | nicht gewebeschädigend | I | keine |
| Cemiplimab | nicht gewebeschädigend | I | keine |
| Cetuximab | nicht gewebeschädigend | I | keine |
| Cisplatin | nicht gewebeschädigend, aber potenziell allergen | III | + DMSO topisch, Kälte |
| Cladribin | nicht gewebeschädigend | I | keine |
| Clofarabin | nicht gewebeschädigend | I | keine |
| Cyclophosphamid | nicht gewebeschädigend | I | keine |
| Cytarabin | nicht gewebeschädigend | I | keine |
| Dacarbazin | gewebereizend | II | Cave! |
| Dactinomycin | gewebenekrotisierend | III | + DMSO |
| Daratumumab | nicht gewebeschädigend | I | keine |
| Daunorubicin | gewebenekrotisierend | III | + DMSO topisch, Kälte CAVE! NICHT bei Einsatz von Dexrazoxan (siehe Hinweise dort) |
| Daunorubicin liposomal | gewebereizend | II | + trockene Kälte |
| Decitabin | nicht gewebeschädigend | I | keine |
| Dinutuximab | nicht gewebeschädigend | I | keine |
| Docetaxel | gewebereizend | II | keine |
| Doxorubicin | gewebenekrotisierend | III | + DMSO topisch, Kälte CAVE! NICHT bei Einsatz von Dexrazoxan (siehe Hinweise dort) |
| Doxorubicin liposomal und pegyliert liposomal | gewebereizend | II | + trockene Kälte |
| Elotuzumab | nicht gewebeschädigend | I | keine |
| Enfortumab Vedotin | gewebereizend | I | keine |
| Epirubicin | gewebenekrotisierend | III | + DMSO topisch, Kälte CAVE! NICHT bei Einsatz von Dexrazoxan (siehe Hinweise dort) |
| Eribulin | nicht gewebeschädigend | I | keine |
| Estramustin | nicht gewebeschädigend | I | keine |
| Etoposid | nicht gewebeschädigend, hoch konzentrierte Lösungen möglicherweise gewebereizend aufgrund der Lösungsmittel | II | keine |
| Etoposidphosphat | nicht gewebeschädigend | I | keine |
| Fludarabin | nicht gewebeschädigend | I | keine |
| Fluorouracil | gewebereizend schmerzhafte, reversible Blasenbildung möglich | I | Uridinsalbe NRF [3] |
| Fotemustin | gewebereizend | II | keine |
| Gemcitabin | gewebereizend | II | keine |
| Gemtuzumab Ozogamicin | nicht gewebeschädigend | I | keine |
| Idarubicin | gewebenekrotisierend | III | + DMSO topisch, Kälte CAVE! NICHT bei Einsatz von Dexrazoxan (siehe Hinweise dort) |
| Ifosfamid | nicht gewebeschädigend | I | keine |
| Inotuzumab Ozogamicin | nicht gewebeschädigend | I | keine |
| Irinotecan | nicht gewebeschädigend | I | keine |
| Irinotecan liposomal | nicht gewebeschädigend | I | keine |
| Ipilimumab | nicht gewebeschädigend | I | keine |
| Isatuximab | nicht gewebeschädigend | I | keine |
| Melphalan | gewebereizend | II | keine |
| Methotrexat | nicht gewebeschädigend | I | keine |
| Mitomycin C | gewebenekrotisierend | III | + DMSO topisch, Kälte |
| Mitoxantron | gewebenekrotisierend | III | + DMSO topisch, Kälte CAVE! NICHT bei Einsatz von Dexrazoxan (siehe Hinweise dort) |
| Mogamolizumab | nicht gewebeschädigend | I | keine |
| Moxetumomab pasudotox | gewebereizend | I | keine |
| Necitumumab | nicht gewebeschädigend | I | keine |
| Nelarabin | nicht gewebeschädigend | I | keine |
| Nivolumab | nicht gewebeschädigend | I | keine |
| Obinutuzumab | nicht gewebeschädigend | I | keine |
| Oxaliplatin | gewebereizend, potenziell allergen | II | CAVE! keine kalten Umschläge! |
| Paclitaxel | hoch konzentrierte Lösungen möglicherweise gewebereizend aufgrund der Lösungsmittel; gewebenekrotisierend aufgrund eines histopathologischen Befundes | + Hyaluronidase s.c. | |
| Paclitaxel, albumin- gebundene Nanopartikel | gewebereizend | II | keine |
| Panitumumab | nicht gewebeschädigend | I | keine |
| Pegaspargase | nicht gewebeschädigend | I | keine |
| Pemetrexed | nicht gewebeschädigend | I | keine |
| Pembrolizumab | nicht gewebeschädigend | I | keine |
| Pentostatin | nicht gewebeschädigend | I | keine |
| Pertuzumab | nicht gewebeschädigend | I | keine |
| Pixantron* | gewebenekrotisierend | III | + DMSO topisch, Kälte CAVE! NICHT bei Einsatz von Dexrazoxan (siehe Hinweise dort) |
| Polatuzumab Vedotin | gewebereizend | I | keine |
| Raltitrexed | nicht gewebeschädigend | I | keine |
| Ramucirumab | nicht gewebeschädigend | I | keine |
| Rituximab# | nicht gewebeschädigend | I | keine |
| Sacituzumab Govitecan | nicht gewebeschädigend | I | keine |
| Streptozocin | gewebereizend | II | keine |
| Tafasitamab | nicht gewebeschädigend | I | keine |
| Temsirolimus | nicht gewebeschädigend | I | keine |
| Teniposid | nicht gewebeschädigend, hoch konzentrierte Lösungen möglicherweise gewebereizend aufgrund der Lösungsmittel | II | keine |
| Thiotepa | nicht gewebeschädigend | I | keine |
| Topotecan | nicht gewebeschädigend | I | keine |
| Trabectedin | gewebereizend | II | keine |
| Treosulfan | gewebereizend | II | keine |
| Trastuzumab# | nicht gewebeschädigend | I | keine |
| Trastuzumab Deruxtecan | nicht gewebeschädigend | I | keine |
| Trastuzumab Emtansin (T-DM1) | nicht gewebeschädigend | I | keine |
| Trimetrexate | gewebereizend | II | keine |
| Vinblastin | gewebenekrotisierend | III | + Hyaluronidase s.c./Wärme |
| Vincristin | gewebenekrotisierend | III | + Hyaluronidase s.c./Wärme |
| Vindesin | gewebenekrotisierend | III | + Hyaluronidase s.c./Wärme |
| Vinflunin | gewebenekrotisierend | III | + Hyaluronidase s.c./Wärme |
| Vinorelbin | gewebenekrotisierend | III | + Hyaluronidase s.c./Wärme |
| Modifiziert nach [4–6]; * Analogschluss zu Mitoxantron, keine Daten verfügbar. # Von diesen Antikörpern gibt es subkutane Darreichungsformen. | |||
Unkonjugierte Antikörper sind nicht gewebeschädigend. Einige wurden von der i.v. Form zur s.c. Darreichungsform entwickelt (Rituximab, Trastuzumab, Daratumumab). Es kann allerdings zu einer lokalen Reaktion im Sinne einer allergischen Reaktion auf das Fremdeiweiß kommen. Einige Toxine der gekoppelten Antikörper könnten auf Grund ihres intrazellulären Wirkungsmechanismus ein stark gewebeschädigendes Potenzial haben. Ob die Antikörper im Paravasatgebiet von ihrem Verbindungsmolekül (Linker) getrennt werden, ist derzeit unklar. Derzeitige Sachlage bei einer sehr begrenzten Anzahl an Extravasationen ist:
Basierend auf klinischer Erfahrung haben toxingekoppelte Antikörper bisher leichte Hautreaktionen verursacht, die höchstens als Irritans zu werten wären.
Radionuklide, genauer radionuklidgekoppelte Antikörper, können sich ebenfalls als vesikant erweisen, wie in dem Fallbericht von Williams und Kollegen dargestellt. Das vesikante Potenzial ist hierbei auf das Radionuklid bzw. auf die applizierte Strahlendosis zurückzuführen [7]. Neben den in obiger Tabelle aufgezeigten Irritanzien und Vesikanzien sind nach McCaffrey Boyle [8] noch die verzögerte Extravasation und die sogenannte „flare reaction“ bekannt: Während bei der verzögerten Extravasation die Symptome erst bis zu 48 Stunden nach der Arzneimittelapplikation auftreten, ist die „flare reaction“ eine lokale, allergische Reaktion aufgrund einer infusionsinduzierten Histaminfreisetzung ohne Schmerzen, aber begleitet von rötlichen Flecken und/oder Streifen entlang der Vene. Weiterhin können Begleitsymptome wie Ödeme und Juckreiz beobachtet werden. Dieses Phänomen ist eine bekannte Nebenwirkung der Anthrazykline bei zirka 3 % der Behandlungen.
| Vorgehensweise bei Paravasaten | |
| 1. | Injektion/Infusion sofort stoppen |
| 2. | Paravasate-Set bereitstellen |
| 3. | (sterile) Handschuhe anziehen |
| 4. | Infusionsleitung bzw. Spritze durch eine 5-ml-Einmalspritze ersetzen und langsam so viel wie möglich vom Paravasat aspirieren; Achtung: keinen Druck auf Paravasationsstelle ausüben |
| 5. | i.v. Zugang unter Aspirationsbedingungen entfernen |
| a) bei nicht gewebeschädigenden Zytostatika (I) | |
| 6. –– | |
| 7. die betroffene Extremität hochlagern und ruhigstellen | |
| 8. –– | |
| b) bei gewebereizenden Zytostatika (II) und gewebenekrotisierenden Zytostatika (III) | |
| 6. bei Blasen: mit 1-ml-Spritze und s.c. Kanüle aspirieren, für jeden Aspirationsversuch neues Besteck verwenden | |
| 7. die betroffene Extremität hochlagern und ruhigstellen | |
| 8. substanzspezifische Maßnahmen einleiten | |
| 9. | Wundauflage: ja, Okklusionsverbände: nein |
| 10. | Paravasate-Dokumentationsbogen ausfüllen (Ausdehnung des Paravasates angeben!) |
| 11. | Aufklärung und Instruktion des/der Patienten/in sowie der Angehörigen |
| 12. | regelmäßige Kontrollen (Nachsorge) |
| 13. | bei gewebenekrotisierenden Zytostatika immer innerhalb von 72 Stunden einen (plastischen) Chirurgen konsultieren |
| Symptom | Zeit |
| Erythem, Ödem (Schmerz) | Tag 0–7 |
| Überwärmung, Schmerz | Tag 8–10 |
| Beginnende Ulzerationen, Schmerzen | ab Tag 7 |
| Zunahme der Ulzera, roter Randwall, gelblicher Grund, Schmerzen | Monat 2–4 |
| Reizfreier Gewebedefekt | elektiv |
Hinweis: Die Einteilung Irritanz ↔ Vesikans ist nicht absolut. Die Verläufe können bei ein und derselben Substanz unterschiedlich verlaufen, so beispielsweise bei Oxaliplatin:
Berichte ohne Gewebsschädigung:
Perez Fidalgo et al. Management of chemotherapy extravasation: ESMO-EONS Clinical Practice Guidelines. Ann Oncol 2012; 23(7 Suppl): vii167
Fallberichte mit Gewebsschädigung – aber keine Nekrose:
Baur et al. (2000) Extravasation of Oxaliplatin (Eloxatin®) – Clinical Course. Onkologie 23:468
Foo et al. (2003) A case report of oxaliplatin extravasation. Ann Oncol 14:961
Wie viele andere Toxizitäten können auch die Extravasationsschäden nach den CTC-AE-Kriterien des National Institute of Health, National Cancer Institute klassifiziert werden; CTC AE = Common Terminology Criteria for Adverse Events.
| Grad 1 | Grad 2 | Grad 3 | Grad 4 | Grad 5 |
| Schmerzloses Ödem | Erythem mit Begleitsymptomen wie Ödem, Schmerz, Induration, Phlebitis | Ulzeration oder Nekrose; schwerer Gewebeschaden; operative Intervention ist indiziert | Lebensbedrohliche Konsequenzen; eilige Intervention ist indiziert | Tod |
3.2 Klinischer Verlauf
Die Tabelle oberhalb zeigt den zeitlichen Ablauf einer paravasatinduzierten Gewebeschädigung. Bestimmte Substanzen werden im Gewebe depotartig „gefangen“ gehalten [9], mit der Folge möglicherweise sehr lang anhaltender Gewebereaktionen. Insbesondere in solchen Fällen, vor allem bei anhaltenden Schmerzen und zeitlich lang andauernden Gewebekonzentrationen, ist eine chirurgische Intervention obligat [9]. (Eine kurze Übersicht chirurgischer Deckungsverfahren ist bei Larson [10] dargestellt.) Ein Stillstand der Gewebereaktion ist zwar auf jeder dargestellten Stufe möglich, da eine Abhängigkeit der Gewebetoxizität von der zugeführten Menge bzw. Dosis besteht [11, 12]. Die teilweise lang anhaltende nekrotisierende Wirkung von Paravasaten (besonders der Anthrazykline) beruht aber, neben einer andauernden Gewebelokalisation, unter anderem auf der Bildung von freien Radikalen (Anthrazykline; siehe auch Teil Grundlagen Abschnitt Wirkungs- und Resistenzmechanismen). Diese Radikale führen unmittelbar zur Denaturierung von DNS. Bei Zelluntergang werden überdies die Komplexe aus an DNS gebundenen Zytostatika von den untergegangenen Zellen in Intervallen freigesetzt. Sie werden dann wiederum durch Endozytose in benachbarte Zellen aufgenommen, wo sie ihre schädigende Wirkung fortsetzen. Sie reagieren quasi nicht ab. Durch diesen Kreislauf werden immer weitere Zellen in Mitleidenschaft gezogen. Somit lässt sich dieser „Teufelskreis“ bei solchen Substanzen nur durch radikale chirurgische Entfernung geschädigter Gewebeteile unterbrechen.
3.3 Risikofaktoren für Paravasate
Es finden sich diverse Risikofaktoren für Paravasate:
3.3.1.1 Latrogene Risikofaktoren für Paravasate
- Auswahl des Injektionsortes (Ellenbogen > Handrücken > Unterarm; > bedeutet schlechter/ungünstiger als; vergleiche Abbildung S. 175, vormals bestrahlte Hautareale)
- wenig Injektionspraxis, Sorglosigkeit, Unversiertheit
- unzureichende Patienteninformation (Meldung bei Missempfindungen/Schmerzen)
- mangelnde Beachtung von geäußerten Patientenbeschwerden
- mangelnde Überwachung des Zugangs
- zu langsames Reagieren bei Auftreten von lokalen Reaktionen/Paravasaten
Substanzabhängige Risikofaktoren für Paravasate
- Substanz ist starkes Vesikans
- Substanzmenge, -konzentration, Osmolarität, pH-Wert im Extravasationsbereich
- Dauer der Schädigung (Zeit)
Patientenabhängige (anatomische und physiologische) Risikofaktoren für Paravasate
- Alter (erhöhte Gefäßbrüchigkeit)
- verminderter Gefäßdurchmesser
- bereits viele Gefäßpunktionen erhalten
- verminderter lokaler Blutfluss aufgrund von venösem Rückstau oder Herz-Kreislauf-Erkrankungen
- erhöhter Venendruck
- obstruierte venöse Drainage nach axillärer Chirurgie
- disseminierte Hauterkrankungen
- Ekzeme, Psoriasis
- Patientenbewegungen / Unruhe
- sensorische Defizite seitens des Patienten
- Paralyse
- Sedierung
- Somnolenz
- beeinträchtigte Wahrnehmung

Auch implantierte Ports sind nicht „narrensicher“ im Hinblick auf Arzneimittelextravasationen. Portnekrosen (Abbildung links) sind nicht nur möglich, sondern auch gefürchtet. Demgegenüber bieten zentrale Venenkatheter (ZVK) ein Höchstmaß an (Extravasations-)Sicherheit. Gründe für Portnekrosen können sein:
- Katheterseparation vom Körperport
- Bruch oder Riss im Katheter
- Riss im Portseptum
- exzessiver Rückstau um die Katheter- oder Portnadel aufgrund eines Fibrinpfropfens an der Katheterspitze
- unvollständige oder schlechte Penetration der Injektionsnadel durch das Portseptum
3.4 Risikominimierung und Präventionsmaßnahmen
Sämtliche Risikofaktoren müssen bewusst gemacht und durch Präventionsmaßnahmen minimiert werden. Präventionsmaßnahmen sind:
- Einschätzung des nekrotischen Potenzials der Substanz durch den Anwender
- Art und Ort des gewählten venösen Zugangs (zentral? peripher? Port? welches Katheter- oder Portsystem?)
- Applikation gegebenenfalls unter Überwachung durch trainiertes Personal
- optimale Umgebungsbedingungen (Lichtverhältnisse, Ruhe, vorübergehende Ruhigstellung der Extremität z. B. mittels Armschiene, Sicherung des Zugangs mittels Pflaster)
- keine Venen mit vorher misslungenen Punktionsversuchen verwenden (nicht unterhalb einer misslungenen Applikation)
- möglichst nicht den Handrücken oder (Ellenbogen-)Gelenksnähe als Punktionsort wählen
- Gängigkeit des Zugangs „testen“ (Blutaspiration, Spülung mit Kochsalzlösung)
- Patienten unterweisen/aufklären (hauseigener Aufklärungsbogen?), Meldung bei den geringsten Missempfindungen
- Kontrolle/Überwachung des Zugangs während längerer Applikationsdauer von Vesikanzien (z. B. Anthrazyklin-Infusionen)
3.5 Primäre Allgemeinmaßnahmen bei Extravasationen
Einen Standard zur Behandlung von Extravasation gibt es nicht, jedoch zahlreiche ähnlich lautende Empfehlungen (Erfahrungswerte). Ebenso fehlt es an spezifischer Therapie – im Sinne eines echten Antagonismus – für eine bestimmte Einzelsubstanz auf der Basis randomisierter Studien (allein schon aus ethischen Gründen undenkbar). Die zu treffenden Allgemeinmaßnahmen sind oben tabellarisch aufgelistet.
Merke:
Alle Therapiehinweise basieren auf
- dokumentierten Fallberichten
- klinischen Anekdoten
Alle Therapiehinweise
- sind Handlungsempfehlungen, z. T. auch basierend auf Extrapolationen
- sind kein Garant für ein reproduzierbar sicheres Ergebnis
- es handelt sich um Notfallbehandlungen im Sinne eines Heilversuchs
3.6 Antidota
Untersuchungen gezielt eingesetzter, potenzieller Antidota gegen nekrotisierende Arzneimittel, speziell von Zytostatika, liegen begrenzt vor [11, 13 –15]. Sie basieren auf Studien an Tieren und weisen überdies inhomogene Ergebnisse auf. Für die Interpretation dieser Studienergebnisse [z. B. 16] muss angemerkt werden, dass
- die in diesen Untersuchungen üblicherweise intradermal applizierten Zytostatika eine höhere Konzentration aufweisen mussten, um eine Reaktion auszulösen, als sie typischerweise im klinischen Alltag zum Einsatz kommen;
- das Verhalten der untersuchten Tiergewebe (Maus, Ratte, Meerschweinchen) sich zum Teil deutlich vom Verhalten menschlichen Gewebes unterscheidet und somit nicht ohne Weiteres auf den Menschen übertragbar ist.
Eine mögliche Folge davon ist, dass eine Substanz, die sich im Tierversuch als nicht effektiv zeigte, beim Menschen aber einen Antidot-Effekt haben könnte [9]. Es existieren diverse Empfehlungen zur Verwendung bestimmter (exotischer) Antidota, die jedoch aus Einzelfallberichten und aus anekdotischen Quellen stammen.
Als Substanzen von gesichertem Wert zur Intervention müssen primär Hyaluronidase und Dimethylsulfoxid (DMSO) angesehen werden.
Hyaluronidase: Durch das Enzym Hyaluronidase werden Hyaluronsäure, Chondroitin- und Mukoitinsulfate depolymerisiert. Es wirkt physiologischerweise als Diffusions- oder auch Spreitungsfaktor (spreading factor) mit Strukturauflockerung von Binde- und Stützgeweben. Damit wird sowohl der Flüssigkeitsaustausch zwischen Geweben und dem Gefäßsystem erleichtert als auch die Ausbreitung von Fremdsubstanzen. Aufgrund dieser Substanzeigenschaften können nach subkutaner/intradermaler Injektion interstitielle Räume geöffnet und/oder vergrößert und eine systemische Aufnahme subkutaner Flüssigkeitsmengen erleichtert werden [14]. Wichtig ist jedoch, dass zur Erreichung dieser Effekte eine ausreichend hohe Hyaluronidasedosierung gewählt wird. Die dosisabhängige Gewebeprotektion konnte in einem Tiermodell gezeigt werden [17]. Zu empfehlen ist eine Dosierung bzw. Konzentration von 150 U pro Milliliter [13, 14, 18]. Es sei jedoch ausdrücklich darauf hingewiesen, dass eine großzügige Umspritzung des Paravasatareals mit Hyaluronidase mit starken, brennenden Schmerzen für den Patienten verbunden ist. Diese bedürfen einer adäquaten symptomatischen Therapie. Die Nutzen-Risiko-Abwägung liegt jedoch eindeutig auf der Seite des Nutzens [19]. Der Hyaluronidase kommt bei Paravasaten mit Vinca-Alkaloiden der größte Stellenwert zu [14, 20]. Bei Paravasaten mit Anthrazyklinen ist das Enzym kontraindiziert, da Hyaluronidase im Tierexperiment(!) die Hautulzeration verstärkt [9].
Dimethylsulfoxid (DMSO): Dimethylsulfoxid ist eine Lösung, die entzündungshemmend, lokal anästhetisch, vasodilatatorisch sowie kollagenauflösend wirkt [8]. Sie hat gute Penetrationseigenschaften in Haut und Gewebe und gilt als potenter Radikalfänger [21]. Konzentrationsabhängige Nebenwirkungen auf der Haut sind Erytheme, Pruritus, Brennen, Stechen, gelegentliche Blasenbildung, Austrocknung und Schuppung. Sie können schon bei 10 %-igen Lösungen auftreten, aber interindividuellen Unterschieden unterliegen. All diese Phänomene basieren auf der Vasodilatation und nehmen mit der Dauer der Anwendung zu. Das insbesondere dann, wenn mit okklusiver Wundabdeckung gearbeitet wird.
Die eingesetzten DMSO-Konzentrationen zur Paravasatbehandlung sind sehr inhomogen und rangieren zwischen 55 % und 100 %. Es gibt derzeit kein DMSO-Handelspräparat zur Behandlung von Paravasaten. Erfahrungsgemäß sollte eine Konzentration der Lösung zwischen 100 % und 80 % angestrebt werden. Es empfiehlt sich, ein hochreines DMSO (reinst) zu verwenden. Dieses wird „frisch“ mit Aqua ad injectabilis auf (höchstens) 80 % verdünnt.
Zur Paravasationsbehandlung wird diese Lösung großzügig auf das Paravasatgebiet aufgetragen. Die Fläche wird dann mit Kompressen locker abgedeckt. Ein Verband, insbesondere ein okkludierender Verband, sollte unbedingt vermieden werden (siehe auch oben). Dieses Verfahren wird an den ersten 3 Tagen in 4-stündigem Abstand wiederholt. Das Intervall kann an den Tagen 4–14 auf 6 Stunden ausgedehnt werden. Diese Behandlung darf nicht zu frühzeitig abgesetzt werden (Patientencompliance).
Es muss sichergestellt werden, dass das nekrotisierende Agens so vollständig wie möglich aus dem Gewebe entfernt (geschleppt) wird. Zwischenzeitlich kann dexamethason- oder mometasonhaltige Fettcreme auf den betroffenen Bereich aufgetragen werden [19], um die DMSO-bedingten kutanen Nebenwirkungen zu begrenzen und um eventuelle, leichte, oberflächliche, paravasatbedingte Entzündungsreaktionen zu lindern.
Eine systemische oder intradermale/intrakutane Glukokortikoid-Applikation ist nicht zu empfehlen. Bisher konnte mit keiner der durchgeführten Untersuchungen ein klinischer Nutzen der subkutanen Glukokortikoid-Applikation gezeigt werden [9, 11, 13, 16, 22]. DMSO-Lösung sollte zur Behandlung von Paravasaten mit Anthrazyklinen [9, 21, 23, 24], Vinca-Alkaloiden [19, 25] und Mitomycin C zum Einsatz kommen [15]. Im Mäusemodell soll DMSO allerdings marginale Effekte bei Paravasaten mit dem ebenfalls zu den Anthrazyklinen gehörenden Daunorubicin zeigen [9].
Aggressive Alkylanzien, wie z. B. Mitomycin C, sollen mit Natriumthiosulfat als Ersatznukleophil chemisch abreagieren. Cisplatin dürfte ebenfalls mit der Substanz abreagieren, bedarf aber üblicherweise keiner Behandlung. Die handelsübliche Thiosulfatlösung darf jedoch nicht unverdünnt zum Einsatz kommen.
Je 5–6 ml der in angloamerikanischer Literatur 1/6- oder 1/3-molar bezeichneten Lösung1 werden durch den noch liegenden Zugang periläsional s.c. injiziert. Nach mehreren Stunden soll die s.c. Gabe wiederholt werden [9].
Unterstützend, neben Hochlagerung der Extremität, kann die lokale Applikation von Wärme oder Kälte sein. Man geht von erhöhtem Blutfluss mit folgender Schmerzlinderung und schnellerer Abschwellung aus. Im Gegensatz dazu kann der lokale Blutfluss durch Kälte reduziert und der zelluläre (nekrotische) Metabolismus vermindert werden. Etabliert ist eine lokale Kühlung bei Paravasaten mit Anthrazyklinen. Paravasate aggressiver Alkylanzien (siehe oben) können ebenfalls mit Kälte positiv beeinflusst werden. Kontraindiziert ist Kälte jedoch bei Paravasaten mit Vinca-Alkaloiden; siehe Empfehlungen zu Einzelsubstanzen sowie [9].
3.7 Substanzspezifische Maßnahmen
Anthrazykline und ähnliche Substanzen (Aclarubicin, Dauno-, Doxo-, Epi-, Ida-rubicin, Losoxantron; Mitoxantron): Initial: Dimethylsulfoxid (DMSO) 80–100 % alle 6 Stunden für im Allgemeinen bis zu 14 Tagen, Extremität hoch lagern, Kältepacks, glukokortikoidhaltige Creme während der Nachbehandlung (siehe oben unter Dimethylsulfoxid).
Seit 2007 steht der Eisenchelator Dexrazoxan (Savene®) als zugelassenes Antidot nach Anthrazyklin-Paravasationen zur Verfügung. Hierbei ist Folgendes zu beachten:
- die erste Infusion muss binnen 6 Stunden nach einer stattgefundenen Paravasation begonnen worden sein
- das mitgelieferte Verdünnungsmittel weist einen recht hohen Gehalt an Kalium und Natrium auf (K+: 98 mg/500 ml, Na+: 1,61 g/500 ml)
- bei Patienten, die mit Dexrazoxan behandelt werden, darf das Extravasationsgebiet nicht gekühlt werden; eine bereits bestehende Kühlung muss mindestens 15 Minuten vor dem Infusionsbeginn beendet werden
- DMSO ist kontraindiziert; bei der Mehrzahl von Mäusen, die zusätzlich zu Dexrazoxan mit DMSO behandelt wurden, entstanden Hautwunden [26]
- Dexrazoxan hat mutagene Eigenschaften [27] und ist wie ein Zytostatikum handzuhaben
Die klinische Effektivität von Dexrazoxan kann derzeit noch nicht abschließend beurteilt werden. Bei den zwei zulassungsrelevanten Studien für Dexrazoxan handelt es sich um zwei einarmige, multizentrische, offene Studien [28]. Ein direkter Wirksamkeitsvergleich mit der sonst, basierend auf klinischer Erfahrung, durchgeführten Behandlung mit Kälte und Pinselung mit DMSO fand nicht statt [23].
Liposomal verkapselte Anthrazykline scheinen nach derzeitiger Datenlage nicht nekrotisierend zu wirken. Es sind zwar Erytheme, Ödeme und weitere Irritationen beschrieben, die Entwicklung von Ulzera bzw. einer Nekrose unterbleibt offenbar. Eine DMSO-Behandlung sollte jedoch, auch aus forensischen Gründen, mindestens erwogen werden.
Carmustin (BCNU): Als „Antidot“ wirkt 8,4 %-iges Natriumhydrogenkarbonat (NaHCO3) nur bei Hautkontakt. Es ist hier jedoch für den Fall von Bruch des Infusionsbehältnisses mit BCNU und folgender Kontamination von Patient oder Pflegepersonal erwähnt. Die Substanz selbst ist nicht vesikant. Phlebitiden werden wahrscheinlich aufgrund von zu wenig verdünnten Infusionslösungen mit dann entsprechend hohem Alkoholgehalt beobachtet. Durch den alkalischen pH wird Carmustin abgebaut.
Mitomycin C: Periläsionale Injektion von Natriumthiosulfat-Lösung; 0,4–0,8 ml pro Injektionsstelle. Faustregel für die zu applizierende Gesamtmenge: 0,5 ml pro mg extravasierter Substanz. Herstellung siehe Anmerkung 1 oben. Nachbehandlung wie Anthrazykline.
Vinca-Alkaloide (Vincristin, Vindesin, Vinblastin, Vinorelbin): Periläsionale Injektion von Hyaluronidase (150 U/ml) 0,1–0,2 ml pro Injektionsstelle.
Merke: Trockene Wärme! Niemals kühlen!
Sonderfall: Vincristin + Doxorubicin im Gemisch. Bei der Behandlung des multiplen Myeloms wurden Vincristin (0,4 mg) und Doxorubicin (9 mg/m2) pro Tag über 96 Stunden appliziert (veraltetes VAD-Schema). Aber auch im dose-adjusted EPOCH Schema werden beide Substanzen über 4 Tage als Dauerinfusion im Gemisch oder als Parallelinfusion verabreicht (VCR 0,4 mg/m², Doxorubicin 10 mg/m²). Aus dem vorher Dargelegten stellt sich nun die Frage bei einer Extravasation: wärmen oder kühlen?
In der Mischung liegt das Anthrazyklin 25-fach höher konzentriert vor als das Vincristin. Auf der Basis dieser Überlegungen empfiehlt es sich, in diesem Fall primär gegen die Anthrazyklinwirkung zu behandeln (DMSO und gegebenenfalls Kühlung).
3.8 Zusammenfassung
Ein abwartendes Verhalten im Fall von Paravasaten, insbesondere mit nekrotisch wirkenden Substanzen, ist weder zeitgemäß noch ethisch und forensisch zu vertreten, sondern erfordert unverzügliches Handeln. Nur bei Paravasaten mit Mitoxantron und den Taxanen ist eine initiale Beobachtung zu rechtfertigen. Das gewebeschädigende Potenzial von Mitoxantron scheint sehr individuell ausgeprägt. Der Substanz werden jedoch Sklerotisierungseigenschaften unterstellt, sodass sie auch zur Pleurodese zum Einsatz kommt.
Bei den meisten Substanzen begrenzt Kühlung ein subkutanes oder subdermales Spreiten der Noxe. In den meisten Fällen scheint Wärme die Gewebenekrose zu verstärken. Vorstellbar wäre eine gesteigerte Gewebedurchblutung mit größerer intradermaler Flächenverteilung. Das gilt jedoch nicht für die Vinca-Alkaloide. Hier scheint Kühlung einen lokalen Aufkonzentrationseffekt zu bewirken, was die Nekrosepotenz quasi noch steigert. Die teilweise noch Wochen später auftretenden oder anhaltenden Schmerzsensationen sind wahrscheinlich neurologisch bedingt. Die topische Nachbehandlung mit DMSO sollte nicht vernachlässigt werden und nicht zu kurz sein (bis 14 Tage). Durch die geeigneten Maßnahmen ist es somit möglich, die Gewebeschäden zu begrenzen und eine drohende Extremitätenamputation zu vermeiden. Bei „alten“ Paravasaten kann ein chirurgisches Débridement (Wundausschneiden) angezeigt sein [10, 18, 25, 29, 30] bzw. stellt dieses noch die einzige Behandlungsoption dar. Von der Apotheke kann beispielsweise ein Paravasateset bereitgestellt werden. Dieses sollte sich griffbereit auf onkologischen Schwerpunktstationen respektive in den Praxen befinden. Der Inhalt muss allerdings regelmäßig auf Vollständigkeit (nebst Verfall!) überprüft werden. Pragmatischerweise sollte eine solche Überprüfung nach jedem bekannten Zugriff auf dieses Set erfolgen. Ein solches Notfallset beinhaltet:
- Kurzanleitung zur Paravasatebehandlung (nicht erst bei Eintritt eines Schadenfalles lesen!)
- Bestandliste
- Einmalspritzen verschiedener Volumina (1 ml, 2 ml, 3 ml, 5 ml, 10 ml und 20 ml)
- Einmalkanülen (s.c. und i.v. Kanülen)
- sterile Kompressen
- Cold-Hot-Pack
- sterile Einmalhandschuhe (OP-Handschuhe)
- Hyaluronidase-Ampullen (zu 1500 Einheiten)
- Dimethylsulfoxid (reinst)
- Aqua ad injectabilis
- Natriumchlorid-Lösung
- glukokortikoidhaltige Salbe oder Creme (Dexamethason oder Mometason)
Es sei abschließend angemerkt, dass nicht nur Zytostatika zu den Vesikanzien gehören. So haben z. B. das vorschriftsmäßig aufgelöste Virustatikum Ganciclovir (Cymeven®) und das Antiepileptikum Phenytoin einen pH-Wert von 11 (wie Natronlauge).
Weitere, nicht zytostatische Substanzen mit Nekrosepotenzial sind in folgender Tabelle wiedergegeben. Dabei sollten Konzentrationseffekte (hoch konzentrierte, hyperosmolare Elektrolytlösungen) jedoch nicht unberücksichtigt bleiben [8].
| Substanzklasse | Wirkstoff |
| Antibiotika | Cephalotin Chloramphenicol Gentamicin Nafcillin Oxacillin Vancomycin |
| Vasopressiva | Dobutamin Dopamin Epinephrin Metarminol Norepinephrin |
| Elektrolyte | Calciumchlorid Calciumglukonat Kaliumchlorid |
| Sonstige | Amitriptylin Diazepam Ganciclovir Glukose >> 10 % Natriumhydrogenkarbonat 8,4 % parenterale Ernährung (TPN) Phenytoin Röntgenkontrastmittel allgemein |
Literatur
- Schneider MS, Distelhorst CW (1989) Chemotherapy-induced emergencies. Semin Oncol 16: 572–578
- Van Sloten Harwood K, Aisner J (1984) Treatment of chemotherapy extravasation: current status. Cancer Treat Rep 68: 939–945
- Barth J (2000) Uridin-Hand-Fußsalbe und Uridin-Haftpaste als effektive Antidota nach akzidenteller Hautkontamination mit 5-Fluorouracil – ein Fallbericht. Krankenhauspharmazie 21: 625–628
- Mader et al (2006) Paravasation von Zytostatika. Springer, Wien
- Barth J (2022) Zytostatika in der Apotheke, 1. Aufl. inkl. 7. Akt.lfg., Deutscher Apotheker Verlag, Stuttgart
- http://www.bccancer.bc.ca/health-professionals/clinical-resources/cancer-drug-manual/drug-index (aufgerufen am 17.04.2024)
- Williams G, Palmer MR, Parker JA, Joyce R (2006) Extravasation of therapeutic yttrium-90-ibritumomab tiuxetan (Zevalin®): a case report. Cancer Biother Radiopharm 21: 101–105
- McCaffey Boyle D, Engelking C (1995) Vesicant extravasation: myths and realities. Oncol Nurs Forum 22: 57–67
- Dorr RT (1990) Antidotes to vesicant chemotherapy extravasations. Blood Rev 4: 41–60
- Larson DL (1982) Treatment of tissue extravasation by antitumor agents. Cancer 49: 1796–1799
- Barr RD, Sertic J (1981) Soft-tissue necrosis induced by extravasated cancer chemotherapeutic agents: a study of active intervention. Br J Cancer 44: 267–269
- Soble MJ, Dorr RT, Plezia P et al (1987) Dose-dependent skin ulcers in mice treated with DNA binding antitumor antibiotics. Cancer Chemother Pharmacol 20: 33–36
- Dorr RT, Alberts DS (1985) Vinca alkaloid skin toxicity: antidote and drug disposition studies in the mouse. J Natl Cancer Inst 74: 113–120
- Dorr RT, Bool KL (1995) Antidote studies of vinorelbine-induced skin ulceration in the mouse. Cancer Chemother Pharmacol 36: 290–292
- Dorr RT, Solble MJ, Liddil JD et al (1986) Mitomycin C skin toxicity in mice: reduced ulceration and altered pharmacokinetics with topical dimethyl sulfoxide. J Clin Oncol 4: 1399–1404
- Dorr RT, Alberts DS, Chen HSG (1980) The limited role of corticosteroids in ameliorating experimental doxorubicin skin toxicity in the mouse. Cancer Chemother Pharmacol 5: 17–20
- Zimmet SE (1996) Hyaluronidase in the prevention of sclerotherapy-induced extravasation necrosis. Dermal Surg 22: 73–76
- Ignoffo RJ, Friemann MA (1980) Therapy of local toxicities caused by extravasation of cancer chemotherapeutic drugs. Cancer Treat Rev 7: 17–27
- Barth J, Bildat S (2000) Empfehlungen zur Behandlung von Paravasaten mit Vinorelbin. Krankenhauspharmazie 21: 622–624
- Bertelli G, Dini D, Forno GB et al (1994) Hyaluronidase as an antidote to extravasation of vinca alkaloids: clinical results. J Cancer Res Clin Oncol 120: 505–506
- Olver IN, Aisner J, Hament A et al (1988) A prospective study of topical dimethyl sulfoxide for treating anthracycline extravasation. J Clin Oncol 11: 1732–1735
- Reilly JJ, Neifeld JP, Rosenberg SA (1977) Clinical course and management of accidental adriamycin extravasation. Cancer 40: 2053–2056
- Bertelli G, Gozza A, Forno GB, Vidili MG, Silvestro S, Venturini M, Del Mastro L, Garrone O, Rosdso R, Dini D (1995) Topical Dimethylsulfoxide for the prevention of soft tissue injury after extravasation of vesicant cytotoxic drugs: a prospective clinical trial. J Clin Oncol 13: 2851–2855
- Lawrence HJ, Walsh D, Zapotowski KA et al (1989) Topical dimethylsulfoxide may prevent tissue damage from anthracycline extravasation. Cancer Chemother Pharmacol 23: 316–318
- Dorr RT (1994) Pharmacologic management of vesicant chemotherapy extravasations. In: Dorr RT, Von Hoff DD (eds) Cancer chemotherapy handbook. 2nd edition. Appelton & Lange, Simon & Schuster Business and Professional Group, pp 109–115
- Langer SW, Thougaard SV, Sehested M, Jensen PB (2006) Treatment of anthracycline extravasation in mice with dexrazoxane with or without DMSO and hydrocortisone. Cancer Chemother Pharmacol 57: 125–128
- TopoTarget A/S (2006) Savene® Brief prescribing information, Fruebjergvej 3, 2100 Copenhagen, Denmark
- Mouridsen HAT, Langer SW, Buter J, Eidtmann H, Rosti G, de Wit M, Knoblauch P, Rasmussen A, Dahlstøm K, Jensen PB, Giaccone G (2006) Treatment of anthracycline extravasation with savene (dexrazoxane): results from two prospective clinical multicentre studies. Ann Oncol; doi:10.1093/annonc/mdl413
- Hirsh JD, Conlon PF (1983) Implementing guidelines for managing extravasation of antineoplastics. Am J Hos Pharmac 40: 1516–1519
- Rudolph R, Larson DL (1987) Etiology and treatment of chemotherapeutic agent extravasation injuries: a review. J Clin Oncol 5: 1116–1126
[1] Herstellung: 4 ml Na2S2O3 + 8 ml Aqua ad inject. ergibt 1/6-molare Lösung; 8 ml Na2S2O3 + 2 ml Aqua ad inject. ergibt 1/3-molare Lösung

